
题目列表(包括答案和解析)
5.将相同质量的镁条分别放在:①氧气 ②空气 ③氮气 ④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是( )
A.②<①<③<④ B.④=①=②=③
C.③<②<①<④ D.③<①<②<④
[解析] 本题考查Mg在O2、空气、N2、CO2中燃烧的反应以及定量分析问题的能力。
Mg在氧气中:2Mg+O2点燃,2MgO
Mg在空气中:2Mg+O2点燃,2MgO(主)
3Mg+N2点燃,Mg3N2(微量)
Mg在二氧化碳中:2Mg+CO2点燃,C+2MgO
设有1 mol Mg完全反应:
①MgO2,MgO―→O―→增重16 g
②MgN2,Mg3N2―→MgN―→N―→增重9.3 g
③MgCO2,MgO+C―→O+C―→增重22 g
故产物质量大小顺序为④>①>②>③。
[答案] C
4.(海南高考)下列溶液能与镁反应生成氢气的是( )
A.氯化铵溶液 B.氢氧化钠溶液
C.碳酸钾溶液 D.饱和石灰水
[解析] 镁是活泼金属,常温下与水不反应,可以与热水缓慢反应,常温下与酸或酸性物质反应能生成氢气,因NH4Cl水解显酸性:NH4++H2ONH3·H2O+H+,故NH4Cl溶液能与镁反应生成氢气。
[答案] A
3.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有钾元素,只需经过物理变化就可以得到钾单质
D.利用潮汐发电是将化学能转化为电能
[解析] B项,蒸发过程只发生物理变化;C项,海水中的钾元素为化合态,得到单质钾为化学变化;D项,潮汐是涨潮、落潮的过程,潮汐发电过程中无化学变化。
[答案] A
2.下列海水中的元素,对其用途的说明中,不正确的是( )
A.锂作为热核反应的重要材料
B.碘用于医药制碘酒
C.铀用于制氢弹
D.镁用于制造飞机、汽车
[解析] 铀用做核燃料,可以制造原子弹;12H、13H才是用于制造氢弹。
[答案] C
1.下列叙述不正确的是( )
A.地球上99%的溴元素以溴单质形式存在于海洋中
B.在每升海水中含量低于1 mg的元素称为海水中的微量元素
C.海水是锂元素的一个重要来源
D.世界上生产的镁大部分来自海水
[解析] 对A项,海水中溴元素主要以化合态形式存在于海洋中,而不是以游离态形式(即单质)存在,故A错误,因此不正确的选A。考查同学们对海水中元素的存在形式及含量的常识性了解。
[答案] A
15.某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答:

实验中甲同学将a g Cu片和12 mL 8 mol·L-1的浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
(1)请写出Cu与浓H2SO4反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
装置E中D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是____________________。实验装置D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)________________________________________________________________________
____________________________。装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是________________________________________________________________________
________________________________________________________________________。
B中应放置的液体(填字母):________。
A.饱和Na2SO3溶液 B.酸性KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
(2)问题讨论:为什么有一定量的余酸但未能使Cu完全溶解,你认为原因是________________________________________________________________________
________________________________。
足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是________。
A.Fe粉 B.BaCl2溶液
C.Ag D.Na2CO3溶液
(3)实验中甲同学向A中反应后溶液中通入一种气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是________(填名称),反应方程式是___________________________。
[解析] 浓H2SO4在与Cu的反应过程中,浓度会逐渐降低,最后不再反应。SO2可以使品红溶液褪色,SO2可以用NaOH溶液吸收,在D的试管口用一团浸有NaOH溶液的棉花团堵住。B装置的作用是贮气,所以应盛放饱和NaHSO3溶液,以降低SO2的溶解度。(3)要使Cu片全部溶解,应该用氧化剂,单质气体应为O2。
[答案] (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
品红溶液褪色 用浸有NaOH溶液的棉花团塞在试管口 试剂瓶中液面下降,长颈漏斗中液面上升 D
(2)随着H2SO4的消耗,浓H2SO4的浓度不断减小,稀H2SO4与Cu不反应 AD
(3)氧气 2Cu+2H2SO4+O2===2CuSO4+2H2O
14.(2010年肇庆模拟)某同学用如图1所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2看不到浑浊现象。经思考后该同学改用图2所示的装置,将气体收集在注射器内,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2时产生现象的速度明显比通入CO2快。
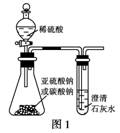
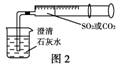
(1)对比分析两组实验,你认为用图1所示装置进行实验时,通入SO2不出现浑浊的原因可能是______________________________。
(2)用图2所示装置进行实验时,以相同速率通入CO2和SO2,SO2产生浑浊、澄清的现象比CO2快的原因是___________________ 。
(3)用图1所示装置进行SO2与石灰水反应的实验若存在缺陷,其改进方法是(若你认为该装置没有缺陷,此空可以不填)______ _。
[答案] (1)制气装置产生SO2速度快,SO2直接与Ca(OH)2生成了可溶于水的酸式盐(CaHSO3),因而看不到沉淀
(2)SO2溶解度大,因而与石灰水反应也快,同时生成的亚硫酸的酸性比碳酸强
(3)用导管将尾气通入NaOH溶液中
13.(2010年广州调研)在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系:
当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。
请回答:
(1)A是________,Y是________,Z是________。
(2)当X是强酸时,E是________,写出B生成C的化学方程式:____________________。
(3)当X是强碱时,E是________,写出B生成C的化学方程式:________________________。
[解析] 由D的相对分子质量比C的相对分子质量大16,容易联想D比C分子增加1个氧原子,则D可能是氧化物,而E为酸,则应为含氧酸,而Y是能提供“O”的物质,A为正盐,与碱反应放出的物质能连续两次氧化最后得一含氧酸,可推知A可能是铵盐:
ANH3NONO2HNO3是可能的,而A与强酸反应时,生成的物质也会连续氧化两次,最后生成含氧酸,则A可能为硫化物(含S2-):
AH2SSO2SO3H2SO4
综合上面叙述可确定A是(NH4)2S。
[答案] (1)(NH4)2S O2 H2O
(2)H2SO4 2H2S+3O22SO2+2H2O
(3)HNO3 4NH3+5O2高温、高压催化剂4NO+6H2O
12.某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-,为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验①_______________________;
实验②__________________________;
实验③____________________________;
实验④____________________________;
实验⑤_____________________________。
(2)上述5个实验不能确定是否存在的离子是________。
[答案] (1)①说明可能含有CO32-或者含有SO32-因为二者水解均显碱性 ②肯定含有CO32-,肯定不含SO32-,因SO2有刺激性气味 ③肯定不含有Br-、I-,因两者均能与氯水反应后生成单质溴和单质碘,溴和碘单质溶解于CCl4显色 ④肯定含有SO42-,因BaSO4不溶于盐酸 ⑤肯定含有Cl-,因AgNO3与Cl-反应生成的AgCl不溶于稀HNO3
(2)NO3-
11.一位同学设计了下列三个实验方案以验证某无色气体中既含有SO2,又含有CO2。
方案一 将无色气体通入酸性KMnO4溶液,KMnO4溶液褪色,反应后气体通入澄清石灰水,石灰水变浑浊。即可证明原无色气体中既含有SO2,又含有CO2。
方案二 将无色气体通入溴水,溴水褪色,将反应后的气体通入澄清石灰水,石灰水变浑浊,证明原无色气体中既含有SO2,又含有CO2。
方案三 将无色气体通入品红试液后再依次通入酸性KMnO4溶液、品红试液,最后通入澄清的石灰水。结果品红试液褪色、KMnO4溶液颜色变浅、品红试液不褪色、石灰水变浑浊,证明原无色气体既含有SO2,又含有CO2。
试回答上述三个方案中,能证明原无色气体中既含有SO2,又含有CO2的方案是__________。简述其理由:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[解析] 分析时一要考虑SO2与CO2的共性是均能使澄清石灰水变浑浊;二要考虑到二者的区别,SO2具有还原性,并能使品红试液褪色,CO2不具备这些性质;三要考虑能使酸性KMnO4溶液、溴水褪色的物质不仅有SO2,还有H2S、C2H4、C2H2等。因此证明既有SO2又有CO2的实验程序一般应为检验SO2存在→除去SO2→证明SO2已除尽→证明CO2存在。符合上述实验程序的应是方案三。
[答案] 方案三 品红试液褪色证明含有SO2,KMnO4溶液颜色变浅、品红试液不褪色证明SO2已除尽,澄清石灰水变浑浊证明含有CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com