
题目列表(包括答案和解析)
15.在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用如下图所示的工艺流程生产单质碘:
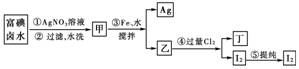
(1)碘位于元素周期表中的第________周期,第________族。
(2)步骤③加Fe的目的是_______________。
(3)写出步骤④的化学方程式:________________________________________________________________________。
(4)上述生产流程中,可以利用的副产物是________,考虑原料循环利用,若将该副产物制成生产所需的试剂,先后还需加入______________来进行处理。
(5)甲物质见光易变黑,其原因是(用化学方程式表示):
__________________________。
(6)第⑤步操作可供提纯I2的两种方法是______和______。
[解析] 分析物质的转化图,逐一分析讨论,可知甲为AgI,乙是由铁和碘化银反应生成的,由于铁在该反应中只能被氧化为+2价,故乙是FeI2,而不是FeI3,而Cl2将FeI2氧化为I2和FeCl3:3Cl2+2FeI2===2I2+2FeCl3。AgI不稳定,具有感光性,见光易分解生成单质碘和银,银不是晶体而为粉末状,显黑色;由于I2单质易升华,易溶于有机溶剂,提纯I2可用升华法或萃取的方法;上述生产流程中,可利用步骤③生成的Ag来制取AgNO3,以循环利用,但步骤③得到的Ag中含有过量的铁,可先加稀H2SO4将铁除去,再溶于稀HNO3制得AgNO3。
[答案] (1)五 ⅦA
(2)使碘化银转化成碘化亚铁(FeI2)和单质银
(3)2FeI2+3Cl2===2I2+2FeCl3
(4)Ag 稀硫酸、稀硝酸
(5)2AgI2Ag+I2
(6)升华 萃取
14.实验探究是体验知识的产生或形成过程的基本途径。下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
|
实验步骤 |
实验结论 |
|
①NaCl溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
氧化性从强到弱的顺序:氯、溴、碘 |
|
②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
|
|
③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(1)完成该实验需用到的仪器是____________;
(2)CCl4在实验中所起的作用是__________;
(3)在实验②中四氯化碳层颜色的变化过程为:__________________________;
(4)该同学的实验缺陷是________________,
改进的办法是_________________________。
[答案] (1)试管、(胶头)滴管
(2)萃取剂
(3)从无色变到橙色(或红棕色)
(4)没有比较Br2和I2的氧化性强弱 将实验③中的氯水改成溴水(或将溴水滴在淀粉KI试纸上,观察试纸是否变蓝色)
13.
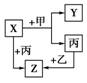
如右图所示,甲、乙、丙是三种常见单质、X、Y、Z是三种常见化合物。它们之间有如下转化关系:
若甲是金属单质,X、Y、Z中有一种是离子化合物,试推断:
(1)X、Y、Z中含有丙元素的是 (填写物质的化学式);
(2)写出X、Y、Z的分子式(或化学式)
X ,Y ,Z ;
(3)Z是 气的主要成分;
(4)X与甲反应的化学方程式是________________________________________________________________________。
[解析] 根据图示可知,X和Z均由乙、丙两种元素组成,又因甲为金属,可知Y应为离子化合物,X和Z为共价化合物,X为CO2,Y为MgO,Z为CO,甲为Mg,乙为O2,丙为C(碳)。
[答案] (1)CO、CO2
(2)CO2 MgO CO
(3)水煤
12.将0.03 mol Cl2缓缓通入含有0.02 mol H2SO3和0.02 mol HBr的混合液中,则溶液中H+的浓度与通入的氯气的物质的量的关系是下列图中的(纵坐标都表示氢离子的物质的量浓度( )
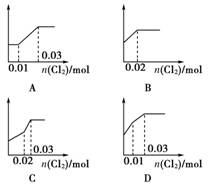
[解析] 因H2SO3的还原性比HBr强,故向二者的混合液中通入氯气时,H2SO3先被氧化,此时溶液中n(H+)、n(Cl-)及溶液中自由移动的离子的浓度将增大,直至H2SO3被消耗完全;继续通入氯气,则发生反应:Cl2+2HBr===2HCl+Br2,此时溶液中n(Cl-)将继续增大,而c(Br-)则减小,但溶液中H+的浓度基本不变。
[答案] B
11.某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是( )
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
[解析] 据①知镁粉与冷水并不反应;据②知镁粉放入溴水中,放出H2很少(溴与水的反应程度很小),但溴水很快褪色,说明镁粉与溴直接发生反应;据③知镁粉与液溴并不反应;据④知水应是镁粉与溴反应的催化剂。
[答案] D
10.近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等。这里的“绿色”是对人类社会可持续发展战略的形象表达。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
A.MgHNO3,Mg(NO3)2
B.MgCl2,MgCl2NaOH,Mg(OH)2稀HNO3,Mg(NO3)2
C.MgO2,MgO稀HNO3,Mg(NO3)2
D.Mg浓H2SO4,MgSO4Ba(NO3)2溶液,Mg(NO3)2
[解析] 据题意,“绿色化学”要求从经济、环保和技术三个方面设计可行的化学反应。从经济角度考虑,B项最不合算,除Mg外还用了三种试剂;D项不合算,用了两种较贵的试剂;从环保角度考虑,A、D两项分别产生了污染环境的氮的氧化物和SO2,B项也使用了会对环境造成污染的Cl2;从技术角度看,D项中Ba(NO3)2溶液的加入量较难控制。
[答案] C
9.某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列有关该同学对实验原理的解释和所得结论的叙述中不正确的是( )
A.第一步反应的离子方程式为:
ClO-+2I-+2H+===I2+Cl-+H2O
B.淀粉KI溶液变蓝是因为I-被氧化为I2,I2遇淀粉变蓝色
C.蓝色逐渐消失的原因是Na2SO3溶液具有漂白性
D.粒子的氧化性由强到弱的顺序是:ClO->I2>SO42-
[解析] NaClO将I-氧化生成I2,I2遇淀粉变蓝色,说明ClO-具有强氧化性,加入Na2SO3溶液后,蓝色逐渐消失,说明I2又被还原成了I-,Na2SO3具有还原性,两步实验可知粒子的氧化性ClO->I2>SO42-。
[答案] C
8.a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中任意一种气体,若a、d两瓶气体混合见光爆炸,a、b两瓶气体混合瓶壁出现暗血红色小液滴,则c瓶装的气体是( )
A.HBr B.HCl
C.Cl2 D.H2
[解析] a、d两瓶气体混合见光爆炸,必为是Cl2和H2而a、b两瓶气体混合瓶壁出现暗血红色小液滴(液溴),必为Cl2和HBr(发生了Cl2+2HBr===2HCl+Br2的反应)。则c中必盛有HCl,同时推出a中为Cl2,b中为HBr,d中为H2。
[答案] B
7.下列物质加入溴水,经振荡,因发生化学反应而使溴水褪色的是( )
①Na2S ②NaOH ③乙酸 ④镁粉 ⑤裂化汽油 ⑥甲苯
A.①②③⑤ B.②④⑤⑥
C.①②④⑤ D.②③④⑥
[解析] ①与溴水发生反应:Na2S+Br2===S↓+2NaBr;②与溴发生反应:Br2+2NaOH===NaBr+NaBrO+H2O;③与溴水不反应;④与溴发生反应:Mg+Br2===MgBr2;Mg+2HBr===MgBr2+H2↑;⑤裂化汽油分子中含有CC双键,与Br2发生加成反应;⑥甲苯可以萃取溴水中的Br2分子,而使溴水褪色。
[答案] C
6.下列叙述中正确的是( )
A.碘易升华,所以要保存在铁盖旋紧的试剂瓶中
B.液溴应保存在磨口玻璃塞棕色细口试剂瓶中,并加少量水进行水封
C.碘易溶于酒精,所以可用酒精从碘水中将碘萃取出来
D.用加热的方法可将碳酸氢钠中混有的少量碘除去
[解析] 碘易升华,生成的碘蒸气可将铁氧化成FeI2,所以A项错误;溴易挥发,水封可减缓挥发,放在玻璃塞的棕色瓶中,防止HBrO见光分解。一般液体药品盛在细口瓶中,固体药品盛在广口瓶中,故B项正确;酒精不能用作萃取剂,萃取碘水中的碘用的试剂必须和水互不相溶;碳酸氢钠在受热时易分解:2NaHCO3Na2CO3+H2O+CO2↑。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com