
题目列表(包括答案和解析)
3.下列实验室中常用仪器的使用方法正确的是( )
A.将胶头滴管插入滴瓶的试剂中,捏瘪胶帽,缓缓松开吸取试剂
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测其pH
C.为防止蒸发皿受热不均匀而炸裂,加热时必须加垫石棉网
D.用过的药匙用干净的纸擦拭干净即可取下一种药品
[解析] 胶头滴管插入滴瓶之前就要捏瘪胶帽,防止胶帽排出的空气浸入试剂;测pH时,pH试纸不能润湿;蒸发皿受热不用加垫石棉网。
[答案] D
2.下列做法正确的是( )
A.将浓硝酸保存在无色玻璃瓶中
B.用镊子取出白磷并置于水中切割
C.把氯酸钾制氧气后的残渣倒入垃圾桶
D.氢气还原氧化铜实验先加热再通氢气
[解析] 浓硝酸应保存在棕色玻璃瓶中;加热氯酸钾制氧气后的残渣应回收,既节约又防止KClO3遇有机物或可燃物发生火灾;氢气还原氧化铜时应先通氢气后加热,防止H2与O2混合受热爆炸。
[答案] B
1.一次实验中,小敏要在试管中取2-3 mL液体加热。其中最后一步操作是( )
A.点燃酒精灯进行加热
B.在试管中加入2-3 mL液体
C.用试管夹夹持在试管的中上部
D.将试剂瓶的瓶盖盖好,放在原处
[解析] 根据题意,A项正确。该题容易误选D,注意取用试剂后,试剂瓶要马上盖好并归回原位。
[答案] A
16.(16分)(2008年海南卷)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2△,2MgO;②3Mg+N2△,Mg3N2;
③2Mg+CO2△,2MgO+C;④Mg+H2O△,MgO+H2↑;
⑤Mg3N2+6H2O===3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
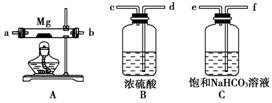
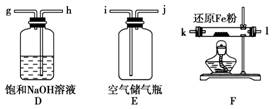
回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是________________________________________________________________________。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)________________________________________________________________________。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?____________________________,原因是__________________________________________。
(4)请设计一个实验,验证产物是氮化镁:________________________________________________________________________
________________________________________________________________________。
[解析] 利用空气和镁粉制取Mg3N2时,应注意除去空气中的O2、CO2及水蒸气,因此,用B来除去水蒸气,用D除去CO2,用F除去O2,将装置按E→D→B→F→A的顺序连接起来。
由于点燃A中酒精灯之前,必须保证装置中含有的气体主要是N2,因此A、F装置的酒精灯不能同时点燃,否则Mg就会与O2反应,须先点燃F装置的酒精灯除去空气中的O2再点燃A装置的酒精灯。
根据题中信息,Mg3N2可与水反应生成Mg(OH)2和NH3,因此只需检测一下产物中是否有NH3即可。
[答案] (1)B:除去水蒸气;D:除去CO2;F:除去O2
(2)j→h→g→d→c→k→1(或1→k)→a→b(或b→a)
(3)制得的Mg3N2中混有杂质 Mg与装置中的O2反应
(4)取少量产物置于试管中,加入适量水,若能产生使湿润红色石蕊试纸变蓝的气体,证明产物是Mg3N2
15.(12分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,为了确定溶液中所含离子及其物质的量浓度,某同学设计实验如下:
取三份100 mL上述水溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加入足量NaOH溶液,加热,收集到气体896 mL(标准状况);
(3)第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,请回答:
(1)溶液中肯定存在的离子是________________;哪些离子的浓度能确定,分别是________________________________________________________________________。
(2)肯定不存在的离子是______________,理由是________________________________________________________________________
________________________________________________________________________。
(3)可能存在的离子是__________,如何确定?________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[答案] (1)NH4+、K+、CO32-、SO42-
c(NH4+)=0.4 mol/L,c(CO32-)=0.2 mol/L,c(SO42-)=0.1 mol/L
(2)Mg2+、Ba2+ 因为溶液中存在CO32-、SO42-,Mg2+、Ba2+不能与CO32-、SO42-共存
(3)Cl- 再取一定量原溶液加入足量的Ba(NO3)2溶液。将得到的沉淀过滤,再向滤液中加入稀HNO3酸化的硝酸银溶液观察是否有沉淀生成,若有沉淀生成说明原溶液中有Cl-,否则没有Cl-
14.(12分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去)。
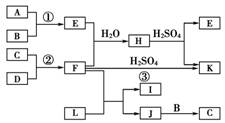
已知:
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
(b)反应①、②是化工生产中的重要反应。
(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。
(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。
(e)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
(1)反应③的化学方程式________________________________________________________________________。
(2)C的结构式________;H的化学式________________________________________________________________________。
(3)L的溶液与化合物E反应的离子方程式________________________________________________________________________
______________________________。
(4)化合物J的化学式________。
[解析] 本题的突破口是E。由于B、C、D是非金属单质,且其中A不是气体,结合“化合物E是形成酸雨的污染物之一”不难推出E为SO2,A为S,B为O2;再根据“反应②是化工生产中的重要反应”及“FH2SO4,K”,且“K是常用的氮肥”可推出F为NH3,则C、D为N2、H2;再结合“JC”和“J由两种元素组成,其相对分子质量为32”,可推出C只能为N2,J为N2H4;又根据“L具有漂白性;可由Cl2与NaOH溶液反应而制得”可推出L为NaClO。
[答案] (1)2NH3+H2SO4===(NH4)2SO4
(2)NN (NH4)2SO3或NH4HSO3
(3)ClO-+SO2+2OH-===Cl-+SO42-+H2O
(4)N2H4
13.(12分)氨气的喷泉实验基本操作步骤可分为以下几步:
A.使倒置烧瓶下端的玻璃管插入盛有水的烧杯里(水中事先加入酚酞试液)
B.取带有喷嘴和止水夹的长玻璃管、吸满水的胶头滴管,先后插入双孔橡皮塞
C.挤压滴管的胶头,使少量的水进入烧瓶
D.取一根带尖嘴的玻璃管,玻璃管的另一端用橡胶管与另一玻璃管相连,并用止水夹夹住橡胶管
E.在干燥的圆底烧瓶中充满氨气
F.将圆底烧瓶用铁夹固定在铁架台上
G.将止水夹移到下端玻璃管上
H.用带有玻璃管和胶头滴管的塞子塞紧瓶口
(1)正确的操作步骤是(填字母):______→______→________→H→A→________G→________。
(2)喷泉实验前如何证明圆底烧瓶中几乎充满了氨气?
________________________________________________________________________
________________________________________________________________________。
(3)喷泉的颜色可因为烧杯中的液体或圆底烧瓶中气体的改变而不同,试填写下表以实现喷泉的颜色变化:
|
烧瓶中的气体 |
烧杯中的液体 |
烧杯中液体的颜色 |
喷泉的颜色 |
|
NH3 |
水+酚酞 |
无色 |
红色 |
|
|
|
红色 |
无色 |
|
|
|
蓝色 |
紫色 |
|
|
|
无色 |
蓝色 |
(4)标准状况下,用排气法收集CO2气体到250 mL烧瓶中,烧杯中盛有0.25 mol/L的NaOH溶液,喷泉实验完成后,进入烧瓶的溶液体积为烧瓶容积的4/5。试判断此时烧瓶中溶液的溶质可能是____________(不考虑由胶头滴管挤入烧瓶中引发实验所用的NaOH溶液)。
根据你的判断,从以下两空选答其中一空:
若溶质只有一种,请计算其物质的量浓度________;
若溶质不止一种,请写出它们的物质的量浓度之比________。
[答案] (1)D→B→E→H→A→F→G→C(或E→D→B→H→A→F→G→C)
(2)将烧瓶倒立,用蘸有浓HCl的玻璃棒靠近瓶口,若有白烟产生,证明氨气已充满(或者用湿润的红色石蕊试纸靠近瓶口看是否变蓝)
(3)
|
烧瓶中的气体 |
烧杯中的液体 |
烧杯中液体的颜色 |
喷泉的颜色 |
|
NH3 |
水+酚酞 |
无色 |
红色 |
|
HCl |
NaOH溶液+酚酞 |
红色 |
无色 |
|
SO2(CO2) |
NaOH溶液+石蕊 |
蓝色 |
紫色 |
|
NO2+O2 |
KI-淀粉试液 |
无色 |
蓝色 |
(4)NaOH和Na2CO3 c(NaOH)∶c(Na2CO3)=18∶5
12.下图为含有同一种元素的a、b、c、d、e五种物质的转化关系。其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是( )
①C ②N2 ③S ④F2
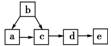
A.只有①和③ B.只有④
C.①②③ D.①②③④
[解析] 此题用代入法,根据选项答案的特点,首先将④中的F2代入,则c、d不可能为F的氧化物,且F不存在最高价氧化物对应的水化物,故B不正确;则答案在A、C两项中选择,然后是将②代入,a为N2,b为NH3,c为NO,d为NO2,e为HNO3,符合题意,故应选C。
[答案] C
11.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,气体很快变为红棕色。下列对原混合气体成分的判断,正确的是( )
A.肯定有SO2和NO B.肯定有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
[解析] 由于气体“无色”,排除掉有色气体Cl2、NO2,同时由于反应2NO+O2===2NO2知,NO和O2只存在一种。由于气体通过品红溶液后,品红溶液褪色,知一定含SO2;剩余气体遇空气迅速变为红棕色,知一定含有NO,则一定不含O2,所以原气体为NO和SO2的混合气体。
[答案] A
10.用下图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
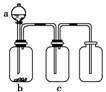
|
|
气体 |
a |
b |
c |
|
A |
NO2 |
浓硝酸 |
铜片 |
NaOH溶液 |
|
B |
SO2 |
浓硫酸 |
Cu |
酸性KMnO4溶液 |
|
C |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
|
D |
CO2 |
稀盐酸 |
CaCO3 |
浓硫酸 |
[解析] 因NaOH溶液可以吸收NO2气体,A项错误;因酸性KMnO4溶液可以吸收SO2,且制备时需有加热装置,B项错误;因收集NH3时应用向下排空气法,C项错误。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com