
题目列表(包括答案和解析)
9.(2010年德州质检)A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去)
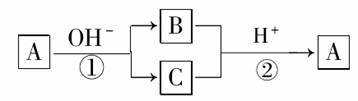
下列判断正确的是( )
A.X元素可能为Al
B.X元素可能是金属,也可能是非金属
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
[解析] 中学阶段符合①的单质有Cl2等卤素单质、硫单质及铝单质;若A为Cl2等卤素单质或S时,也符合②,若A为Al时不符合②,故A为非金属单质中的Cl2等卤素单质或硫;反应①的产物与反应②的反应物不同,①②不互为可逆反应。
[答案] D
8.等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则AlCl3和NaOH两种溶液的物质的量浓度之比可能为( )
①1∶3 ②2∶3 ③1∶4 ④2∶7
A.①② B.①③
C.②④ D.③④
[解析] 溶液中铝元素的存在形式可以是Al3+或[Al(OH)4]-。故当溶液中Al3+与Al(OH)3物质的量之比为1∶1时,n(Al3+)∶n(OH-)=2∶3;当溶液中[Al(OH)4]-与Al(OH)3的物质的量之比为1∶1时,n(Al3+)∶n(OH-)=2∶7。
[答案] C
7.下列各组溶液中,只用试管和胶头滴管,不用其他任何试剂就可以鉴别的是(多选)( )
A.KOH和Al2(SO4)3 B.稀盐酸和Na2CO3
C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4
[解析] A、B选项中两种试剂添加顺序不同产生的现象也不同,可以用此来鉴别两溶液;而C、D选项中两种试剂无论加入的顺序如何不同,现象是一样的,故不借助其他试剂是无法鉴别的。
[答案] AB
6.某溶液中有NH4+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
A.NH4+和Fe2+ B.Al3+和NH4+
C.Al3+和Fe2+ D.Mg2+和Al3+
[解析] 溶液中加入过量NaOH溶液,微热,再加入过量盐酸,发生下列反应:NH4++OH-NH3↑+H2O(使NH4+大量减少);Mg2++2OH-===Mg(OH)2↓,Mg(OH)2+2H+===Mg2++2H2O(Mg2+不变);Fe2++2OH-===Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3。Fe(OH)3+3H+===Fe3++3H2O(使Fe2+变为Fe3+而大量减少);Al3++4OH-===[Al(OH)4]-,[Al(OH)4]-+4H+===Al3++4H2O(Al3+不变)。
[答案] A
5.向100 mL 0.25 mol·L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和Na[Al(OH)4]的澄清溶液,则加入金属钠的质量是( )
A.3.45 g B.2.3 g
C.1.15 g D.0.575 g
[解析] n(Na)=n(NaCl)+nNa[Al(OH)4]=n(Cl-)+n(Al3+)=0.1 mol。
[答案] B
4.(2010年滨州质检)用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③
C.②③⑤③ D.①③⑤③
[解析]
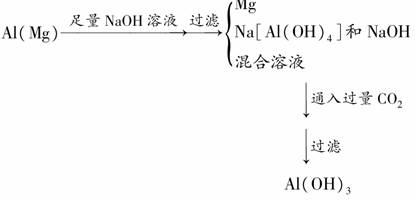
[答案] B
3.
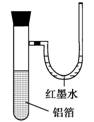
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图所示),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
[解析] 本题是一道考查铝的化学性质的实验题。该实验是一个“毛刷实验”,原理是2Al+3Hg(NO3)2===2Al(NO3)3+3Hg,Al-Hg构成原电池,加快铝失电子:4Al+3O2===2Al2O3,该反应是一个放热反应,使试管内气体的压强增大,U形管中的红墨水左端下降,右端上升,故D项错误。
[答案] D
2.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2 mol·L-1H2SO4溶液 B.18 mol·L-1H2SO4溶液
C.6 mol·L-1KOH溶液 D.3 mol·L-1HNO3溶液
[解析] 镁铝合金在HNO3溶液中反应不生成H2,排除D;与浓H2SO4反应也不生成H2,排除B;Mg、Al均可与稀H2SO4反应,只有Al能与KOH溶液反应,因此放出H2最多的是A。
[答案] A
1.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A.稀硝酸 B.稀盐酸
C.硝酸铜 D.氢氧化钠
[解析] 铝条钝化时表面生成了一层致密的Al2O3,该物质为两性氧化物,既能和强酸反应,又能和强碱反应,所以钝化的铝条能和稀硝酸、稀盐酸、氢氧化钠溶液发生反应,但不能和硝酸铜反应,正确答案为C。
[答案] C
15.(2010年连云港调研)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
Ⅰ.某兴趣小组用如下图所示装置进行Mg与SO2反应的实验。
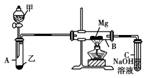
(1)选择制取SO2的合适试剂________。
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体
④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式________________________。装置C中的NaOH溶液的作用是___________。
(3)你认为该装置是否有不足之处?________。如果有,请指出错误________________________________________________________________________
________________________________________________________________________。
Ⅱ.某研究小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃引发的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④SiH4在空气中自燃
他们在研究报告中记载着:“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……”在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,且“实验室制Si”的产率也只有预期值的63%左右。
(4)该小组“实验室制Si”的化学方程式是________________________________________________________________________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是________________________________________________________________________
________________________________________________________________________。
[解析] (1)实验室中用Na2SO3固体和较浓硫酸制取SO2,SO2溶解度较大,故不能用稀硫酸,选择试剂②③。
(2)B管中镁与SO2反应类似于Mg与CO2的反应:SO2+2Mg2MgO+S;多余的SO2需用NaOH溶液吸收,以防止大气污染。
(3)该装置中生成的SO2需干燥,同时B、C之间应加一个安全瓶防止倒吸,C装置应将胶塞去掉,以平衡气压。
(4)同理镁与SiO2反应为:2Mg+SiO22MgO+Si。
(5)根据题给信息,SiH4易自燃,故发现有爆鸣声和火花,其反应为:2Mg+Si===Mg2Si;Mg2Si+2H2SO4===2MgSO4+SiH4↑;SiH4+2O2===SiO2+2H2O。
金属镁与生成的硅继续反应得到硅化镁,硅化镁与硫酸反应生成的SiH4在空气中自燃。
[答案] (1)②③
(2)SO2+2Mg2MgO+S 吸收多余的SO2,防止污染环境
(3)有 一是A、B之间缺少干燥装置;二是B、C之间应加一个安全瓶防止倒吸;三是C装置没有与大气相通
(4)2Mg+SiO22MgO+Si
(5)金属镁与生成的硅继续反应得到硅化镁,硅化镁与硫酸反应生成的SiH4在空气中自燃(或用化学方程式说明:2Mg+Si===Mg2Si;Mg2Si+2H2SO4===2MgSO4+SiH4↑;SiH4+2O2===SiO2+2H2O)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com