
题目列表(包括答案和解析)
4.下列事实能说明金属甲比金属乙的活动性强的是( )
A.在发生化学反应时,甲原子失电子数比乙原子多
B.甲的阳离子的氧化性比乙离子强
C.甲的氢氧化物只有碱性,乙的氢氧化物为两性
D.在甲、乙、硫酸组成的原电池中,甲为负极
[解析] A不正确,金属活动性越强,则金属原子的失电子能力越强,失电子能力和失电子数目无关;B不正确,阳离子的氧化性越强,则其原子的还原性越弱;C不正确,如Cu(OH)2以碱性为主而Al(OH)3具有两性,但显然铜的金属活动性小于铝;D正确,在原电池反应中,活泼金属作负极,被氧化腐蚀。
[答案] D
3.现代建筑的门窗架常用电解加工成的古铜色硬铝制造。取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为(提示:Si+2OH-+H2O===SiO32-+2H2↑)( )

A.Al、Mg、Si、Zn B.Al、Fe、Zn、Na
C.Al、Na、Cu、Fe D.Al、Cu、Mg、Si、Mn
[解析] 通过反应①知合金中必须含有排在金属顺序中H之前的金属和H之后的金属;由反应②知合金中必须含有Si及排在金属活动顺序表H之后的金属或其他非金属。
[答案] D
2.所谓合金就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物或冷却后的固体。下表中金属难与表中其他金属形成二元合金的元素是(多选)( )
|
|
Fe |
Cu |
Zn |
Ag |
Au |
W |
|
熔点/℃ |
1 535 |
1 083 |
419.5 |
960.8 |
1 063 |
3 380 |
|
沸点/℃ |
2 750 |
2 595 |
907 |
2 212 |
2 707 |
5 627 |
A.Fe B.Zn
C.Ag D.W
[解析] 若形成合金则需要两种金属有共同的熔化状态。而B的熔点过低,D的熔点过高,难以与其他金属形成共熔物(即合金)。
[答案] BD
1.下列有关金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均相同
D.金属元素的单质在常温下均为固态
[解析] A不正确,对于变价金属离子,较低价态的金属离子既有氧化性又有还原性,如Fe2+;B正确,因为金属元素的原子只具有还原性,故在化合物中只显正价;C不正确,有变价金属元素;D不正确,少数金属在常温下为液态,如Hg。
[答案] B
15.现有A、B、C三种均含同一种金属元素的无机化合物,它们之间的转化关系如下图(部分产物已略去)所示:

(1)请写出B转化为C的所有可能的离子方程式________________________________________________________________________
________________________________________________________________________,
A与C反应的离子方程式__________________。
(2)若化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则固体混合物中Mg的质量为________;NaOH溶液的物质的量浓度为________。

[解析] (1)符合图示转化关系的可能有下列情形:

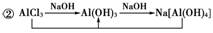
若B为Na2CO3相应离子方程式为
B―→C:CO32-+H2O+CO2===2HCO3-
A+C:OH-+HCO3-===CO32-+H2O。
若B为Al(OH)3,A、C分别为可溶性铝盐和四羟基合铝酸盐或可溶性四羟基合铝酸盐和铝盐。若为前者,则D为NaOH等强碱,B―→C的离子方程式为:Al(OH)3+OH-===[Al(OH)4]-;若为后者,则D为HCl、H2SO4、HNO3等强酸,B―→C的离子方程式为:Al(OH)3+3H+===Al3++3H2O。两种情况下,A与C反应的离子方程式均为:Al3++3[Al(OH)4]-===4Al(OH)3↓。
(2)由图象知n(Mg)=n[Mg(OH)2]=0.15 mol
故m(Mg)=0.15 mol×24 g·mol-1=3.6 g
溶解0.20 mol Al(OH)3耗NaOH的物质的量可由以下化学方程式计算
Al(OH)3+NaOH===Na[Al(OH)4]
=
c(NaOH)=5 mol/L。
[答案] (1)Al(OH)3+OH-===[Al(OH)4]-,
Al(OH)3+3H+===Al3++3H2O
Al3++3[Al(OH)4]-===4Al(OH)3↓
(2)3.6 g 5 mol/L
14.金属镁和铝在工农业生产以及人们日常生活中有着十分广泛的用途。某化学兴趣小组的同学们决定对镁、铝及其化合物的性质比较展开探究活动。探究过程中发现了一些“异常”现象。
(1)镁条在空气中点燃,发出耀眼的白光;用铝箔在酒精灯上加热,铝箔不能燃烧,铝箔卷缩悬垂却不脱落。将已“卷缩”的铝箔冷却后投入氢氧化钠溶液中,有气体生成。写出“卷缩”铝箔冷却后投入氢氧化钠溶液中发生的离子反应方程式:
①________________________________________________________________________;
②________________________________________________________________________。
(2)常温下,在经过砂纸打磨的铝片中取两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中,发现铝片在稀盐酸中产生氢气的速率比在稀硫酸中快。
Ⅰ.写出以上反应的离子方程式:________________________________________________________________________。
Ⅱ.你认为出现以上现象的可能原因是:
假设①______________;假设②________________。
Ⅲ.请设计实验对以上的假设进行验证:
①________________________________________________________________________;
②________________________________________________________________________。
[答案] (1)①Al2O3+2OH-+3H2O===2[Al(OH)4]- ②2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
(2)Ⅰ.2Al+6H+===2Al3++3H2↑
Ⅱ.假设①:Cl-对铝和酸的反应有促进作用 假设②:SO42-对铝和酸的反应有抑制作用
Ⅲ.①在铝和硫酸反应的容器中加固体氯化钠,看是否加快放出氢气的速率 ②在铝和盐酸反应的容器中加入固体硫酸钠,看是否减慢放出氢气的速率
13.由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图所示的转换关系,已知C为密度最小的气体,甲是电解质。

根据图示转化关系回答:
(1)写出下列物质的化学式:
A ,B ,乙 ,丁 。
(2)组成单质A的元素在周期表中的位置是________________________________________________________________________,
丙的电子式是 。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式________________________________________________________________________;
②乙与过量CO2反应的离子方程式________________________________________________________________________。
[解析] 单质C是密度最小的气体,应为H2;单质A与NaOH溶液反应可生成H2,A+B―→甲,甲亦能与NaOH溶液反应,容易考虑A为Al或Si,B为O2,则甲为Al2O3或SiO2,由于甲是电解质,故甲不能为SiO2,则A为Al,甲为Al2O3,乙为Na[Al(OH)4],丁为Al(OH)3。
[答案] (1)A.Al B.O2 乙.Na[Al(OH)4]
丁.Al(OH)3
(2)第3周期ⅢA族 
(3)①2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
②[Al(OH)4]-+CO2===Al(OH)3↓+HCO3-
12.在含a mol AlCl3的溶液中,加入含b mol NaOH的溶液,判断以下各项中铝元素的存在情况。
A.若a=,铝元素全部以________形式存在。
B.若a=,铝元素全部以________形式存在。
C.若<a<,铝元素以________形式存在。
D.若a>,铝元素以________形式存在。
E.若a<,铝元素以________形式存在。
[解析] AlCl3与NaOH反应有两个临界点:1∶3时恰好反应生成Al(OH)3,1∶4时恰好反应生成Na[Al(OH)4]。因此a=时,铝元素均以Al(OH)3形式存在,a=时,铝元素均以[Al(OH)4]-形式存在,当<a<时,铝元素以Al(OH)3和[Al(OH)4]-形式共存,当a>时,AlCl3过量,铝元素以Al3+和Al(OH)3形式共存,当a<时,NaOH过量,铝元素以[Al(OH)4]-形式存在。
[答案] A.Al(OH)3 B.[Al(OH)4]- C.Al(OH)3和
[Al(OH)4]- D.Al3+和Al(OH)3 E.[Al(OH)4]-
11.某同学到实验室中做铝热反应的实验,但是他有些问题还不清楚原因,请你帮他解决这些问题:
(1)铝热剂是指________________________。
(2)引发铝热反应的操作是________________________。
(3)氯酸钾在铝热反应中起的作用是________________________________________________________________________。
[答案] (1)铝与一些金属氧化物的混合物
(2)①在铝热剂表面铺上氯酸钾固体;②将镁条插入混合物中央,点燃
(3)KClO3利用Mg燃烧产生的热量而分解产生的O2又促进镁条燃烧,镁条燃烧产生大量的热,促使铝热反应发生
10.已知Ba[Al(OH)4]2可溶于水,如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是(多选)( )
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:[Al(OH)4]-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
[解析] 向Al2(SO4)3溶液中逐滴加入Ba(OH)2发生的反应如下:
O-b段:3Ba(OH)2+Al2(SO4)3===3BaSO4↓+2Al(OH)3↓。
b-d段:2Al(OH)3+Ba(OH)2===Ba[Al(OH)4]2。
由此可以看出在a-b段沉淀的物质的量BaSO4比Al(OH)3多,A项错;
c-d段溶液中[Al(OH)4]-比Ba2+多,B项正确;
a-d时,由Al2(SO4)3的组成可知整个反应过程中n(BaSO4)>n[Al(OH)3],C项错;
d-e时,因d点就已存在了可溶的Ba[Al(OH)4]2,所以d-e时,溶液中溶质为Ba[Al(OH)4]2和Ba(OH)2,D项正确。
[答案] BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com