
题目列表(包括答案和解析)
9.下列各微粒:①H3O+、NH4+、Na+;②OH-、NH2-、F-、③O22-、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是( )
A.①②③ B.①②④
C.②③④ D.①③④
[解析] ①组质子数均为11,电子数均为10;②组质子数均为9,电子数均为10;③组质子数依次为16、11、12,电子数依次为18、10、10;④组质子数、电子数均为10。
[答案] B
8.下列符号表示同一种元素的是( )
①1735X ②1737X 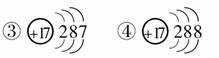
A.只有①③ B.只有②③
C.只有①②③ D.全部
[解析] ①②③表示氯原子,④表示Cl-,四者均表示同一种元素。
[答案] D
7.设某元素原子的核内质子数为m,中子数为n,则下列论断正确的是( )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳原子质量为w g,此原子的质量为(m+n)·w
D.核内中子的总质量小于质子的总质量
[解析] 某元素原子的核内质子数为m,中子数为n,则该原子的质量数为m+n。由于题目没有明确该元素还有没有其他同位素原子,因此该元素的相对原子质量不能确定,则A正确,B错误;根据同位素的相对原子质量的定义式,有m+n=,解得m(X)=g,则C错误;质子数与中子数的大小关系不确定,则质量也不确定,D错误,故答案为A。
[答案] A
6.已知一个SO2分子的质量为x kg,一个SO3分子的质量为y kg,假设两种分子中硫原子、氧原子分别具有相同的中子数,若以硫原子质量的1/32作为相对原子质量的标准,则SO2的相对分子质量可表示为( )
A. B.
C. D.
[解析] 对于SO2和SO3的组成,可知1个氧原子的质量为(y-x)kg,根据1个SO2或1个SO3的分子质量可计算出1个硫原子的质量m(S)=x kg-2(y-x)kg=(3x-2y)kg,则:Mr(SO2)==。
[答案] B
5.假设R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则W g Rm-离子所含中子的物质的量为( )
A.(A-x+m)mol B.(A-x-m)mol
C.(A-x+m)mol D.(A-x-m)mol
[解析] 根据n(Rm-)=≈mol,所以W g Rm-离子所含中子的物质的量为:(A-x+m)mol。
[答案] C
4.(2010年莆田质检)简单原子的原子结构可用图表示方法形象表示:
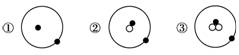
其中表示质子或电子,表示中子,则下列有关①②③的叙述正确的是( )
A.①②③互为同位素
B.①②③为同素异形体
C.①②③是三种化学性质不同的粒子
D.①②③具有相同的质量数
[解析] 从图中可知①②③中的质子数等于电子数且均为1,可知①②③分别代表11H、12H、13H三种核素,故答案为A。
[答案] A
3.铋(Bi)在医药方面有重要应用。下列关于 83209Bi和 83210Bi的说法正确的是( )
A. 83209Bi和 83210Bi都含有83个中子
B. 83209Bi和 83210Bi互为同位素
C. 83209Bi和 83210Bi的核外电子数不同
D. 83209Bi和 83210Bi分别含有126和127个质子
[解析] 83209Bi与 83210Bi互称同位素,具有相同的质子数(83)和核外电子数,但是中子数分别为126、127,故A、C、D错误,B正确。
[答案] B
2.自从1803年英国化学家、物理学家道尔顿提出原子假说以来,人类对原子结构的研究不断深入、不断发展,通过实验事实不断地丰富、完善原子结构理论。请判断下列关于原子结构的说法正确的是( )
A.所有的原子都含有质子、中子和电子三种基本构成微粒
B.所有的原子中的质子、中子和电子三种基本构成微粒的个数都是相等的
C.原子核对电子的吸引作用的实质是原子核中的质子对核外电子的吸引
D.原子中的质子、中子和电子三种基本构成微粒不可能再进一步分成更小的微粒
[解析] 所有的原子都含有质子和电子,并且二者在数值上是相等的。因为质子和电子带的电荷相等,而电性却相反故整个原子是电中性的。需要注意的是,并不是所有的原子都是由质子、中子和电子组成的。如11H中就只含有一个质子和一个电子,没有中子。多数原子的中子数和质子数比较接近但没有必然的数量关系。故A、B选项均不正确。原子核对核外电子的吸引是一种电性作用,因为中子不显电性,质子和电子带相反电荷,所以C选项正确。从发展的观点出发,原子中的质子、中子和电子三种构成原子的基本微粒有可能再进一步分成更小的微粒,目前有资料介绍,科学家已经研究发现了更小的微粒--夸克,所以D选项是错误的。
[答案] C
1.某元素的原子最外层有2个电子,则该元素可能是( )
A.金属元素 B.稀有气体元素
C.第ⅡA族元素 D.以上叙述都可能
[解析] 符合题意的元素包括He、ⅡA族元素(均为金属元素)及过渡元素中的部分元素(均为金属元素)。
[答案] D
15.已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol·L-1硫酸、2 mol·L-1硝酸、2 mol·L-1NaOH溶液、20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设
假设1:该混合金属粉末中除铝外还含有________元素;
假设2:该混合金属粉末中除铝外还含有________元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素。
(2)设计实验方案
基于假设3,设计出实验方案。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
[提示] Ⅰ.注意前后内容对应;
Ⅱ.注意文字简洁。
|
编号 |
实验操作 |
预期现象与结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
[解析] (3)检验合金中除铝外还有铁、铜,可根据Al溶于NaOH溶液,而Fe、Cu不溶,将合金溶解于足量NaOH溶液,过滤,向滤出的固体上加足量的稀硫酸,Fe溶解而Cu不溶解,过滤,向溶液中加稀硝酸和KSCN溶液进一步检验Fe3+,将滤出的固体溶解于稀硝酸,向反应后的溶液中加足量NaOH溶液来检验Cu2+。
[答案] (1)Cu Fe(答案的顺序可交换)
(3)
|
编号 |
实验操作 |
预期现象与结论 |
|
① |
用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 |
样品部分溶解,并有气体放出 |
|
② |
往试管A的剩余固体中加过量稀硫酸,充分反应后,静置;取上层清液于试管B中,剩余固体备用 |
固体部分溶解,并有气体放出,溶液呈浅绿色,可能含铁 |
|
③ |
往试管B中加入少许稀硝酸,再滴加KSCN溶液 |
溶液先变成黄色,加KSCN后显血红色,结合②可知,一定含铁 |
|
④ |
往②剩余固体中加入稀硝酸,再滴加NaOH溶液 |
固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,一定含铜 |
k&s%5¥u
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com