
题目列表(包括答案和解析)
2.(2010年广州调研)已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质。氟元素原子的核外电子排布示意图为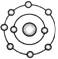 。下列原子中,与氟元素原子的化学性质相似的是( )
。下列原子中,与氟元素原子的化学性质相似的是( )

[解析] 从A项到D项,原子最外层电子数依次为8、4、2、7,故D项符合题意。
[答案] D
1.A和B是同周期相邻的元素,A和C是同主族相邻的元素,已知三种元素的核电荷数之和为33,则A可能为(多选)( )
A.S B.O
C.Si D.C
[解析] 因为题目中A和B是同周期相邻的元素,原子序数A大于B还是A小于B都有可能,类似的A和C同主族,原子序数也可能A大于C或A小于C,所以画出四种元素在周期表中的各种可能相对位置后分别进行计算。
①
|
B |
A |
|
|
C |
②
|
A |
B |
|
C |
|
③
|
C |
|
|
A |
B |
④
|
|
C |
|
B |
A |
设A的原子序数为x,按A+B+C的顺序分别计算如下:
①x+(x-1)+(x+8)=33,x=26/3,不合理;
②x+(x+1)+(x+8)=33,x=8,A为氧元素;
③x+(x+1)+(x-8)=33,x=40/3,不合理;
④x+(x-1)+(x-8)=33,x=14,A为硅元素。
[答案] BC
17.X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________________。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成一价阴离子,该阴离子的电子总数是________,与该离子电子总数相等的Z与氢形成的微粒是______________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为________________________________________________________________________。
(5)ZW3常温下呈液态,可与水反应生成一种酸和一种碱,反应的化学方程式为____________________________________________________________。
(6)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是________(用酸的分子式表示)。
[解析] (1)X原子M层上的电子数是原子核外电子层数的2倍,说明X共有3个电子层,且M层上有6个电子,即
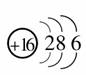 ,为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物水溶液显碱性,中学阶段要求掌握的碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素。
,为硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物水溶液显碱性,中学阶段要求掌握的碱性气体只有NH3,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素。
(2)碳的放射性同位素 146C可用于考古。
(3)氮元素与氢元素形成-1价阴离子,由于氮元素显示-3价,氢显+1价,因此该阴离子为NH2-其电子总数是10,与该离子电子数相等的还有NH3、NH4+。
(4)Cl2与SO2在水溶液中反应:Cl2+SO2+2H2O===4H++2Cl-+SO42-。
(5)NCl3与H2O反应生成物中有碱,只能是NH3·H2O,N为-3价,Cl为+1价,酸应为HClO。
(6)H2CO3、HNO3、H2SO4、HClO4中化学性质明显不同于其他三种酸的是H2CO3,H2CO3为弱酸。
[答案] (1) 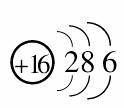 (2) 146C
(2) 146C
(3)10 NH4+、NH3
(4)Cl2+SO2+2H2O===4H++2Cl-+SO42-
(5)NCl3+4H2O===3HClO+NH3·H2O
(6)H2CO3
16.根据X、Y、Z、W四种常见元素的下列信息,回答有关问题:
信息1:上述四种元素电子层数≤3,原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息1,X一定不是________(填序号);
A.氢 B.碳
C.氧 D.硫
信息2:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素______(填“是”或“否”);
信息3:向上述四种元素的单质组成的混合物中加入足量稀盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)生成的白色沉淀物的化学式为__________;
信息4:向上述四种元素的单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入足量的稀盐酸,最终溶液中析出白色沉淀。
(4)生成的白色沉淀物的化学式为________。
[解析] (1)若X为硫,则Y、Z、W原子序数大于16,使至少有一种元素核外电子层数超过3层,而与题意不符。
(2)上述四种元素的氧化物两种与酸反应,三种与碱反应,说明至少有一种是两性的,故其中有铝元素。
(3)可溶于酸的金属是Mg、Al,其盐溶液加过量NaOH溶液生成的白色沉淀为Mg(OH)2。
(4)能溶于烧碱溶液的固体有Al、Si、P、S,但加入足量盐酸生成沉淀且为白色的为H2SiO3。
[答案] (1)AD (2)是 (3)Mg(OH)2 (4)H2SiO3
15.短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍;X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是________;Y元素的名称是________;Z元素的名称是________。
(2)XZ3化合物的化学式是________,电子式是________。
(3)分别写出X、Y的含氧酸的化学式________、________。
[解析] 由题意可知,Y原子核外电子排布为2、4或2、8、6,若为后者,原子序数X>Y,X原子核外也有三层电子,两原子的电子层数的和为6,不符合题意,所以Y和X都有两电子层,Z只有一电子层,又由XZ3可知Z为氢。
[答案] (1)氮 碳 氢 (2)NH3 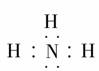 (3)HNO3 H2CO3
(3)HNO3 H2CO3
14.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式为________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式为________。
(4)F是由两种元素组成的三原子分子,其分子式为________;电子式是________。
(5)G分子中含有4个原子,其分子式是________。
(6)H分子中含有8个原子,其分子式是________。
[解析] (1)因A+、B-、C2-都含有18个电子,故A为钾(K),B为氯(Cl),C为硫(S)。
(2)D是由两种元素组成的双原子分子,则其分子式应为HCl。
(3)因为E是所有含18个电子微粒中氧化能力最强的分子,根据元素周期律知识应是氟(F2)。
(4)F是由两种元素组成的三原子分子,其分子式应为H2S,电子式为 。
。
(5)G分子中含有4个原子,其分子式为PH3或H2O2。
(6)H分子中含有8个原子,其分子式为C2H6。
[答案] (1)K Cl S (2)HCl (3)F2
(4)H2S 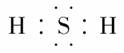
(5)H2O2(答PH3同样也对) (6)C2H6
13.按要求写出下列各化学用语:
(1)含8个中子的碳原子的符号________。
(2)F-的结构示意图:____________。
(3)与N2具有相同电子数的一种双原子分子________。
(4)4个原子、10个电子的一种阳离子________。
[答案] (1) 146C 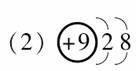 (3)CO (4)H3O+
(3)CO (4)H3O+
12.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质不可能有( )
A.能与碳反应 B.能与硫酸反应
C.能与氢氧化钠反应 D.能与碳酸钠反应
[解析] 由题给条件可知A为氧,B为硅。A、B形成的化合物为SiO2,SiO2和H2SO4不反应。
[答案] B
11.下列有关叙述正确的是( )
A.最外层有5个电子的元素有可能是金属元素
B.非金属元素的最外层电子数一定大于其电子层数
C.非金属元素R的最高价含氧酸为HaROb,则其氢化物为HaR
D.最外层电子数为3的元素不可能是非金属元素
[解析] A中铋元素最外层有5个电子,为金属元素;B中如H最外层电子数等于其电子层数;C中HaROb中R的化合价为+(2b-a),则R的氢化物分子式为H8-2b+aR;D中最外层电子数为3的硼元素是非金属元素。
[答案] A
10.X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n,则下列关系正确的是(多选)( )
A.a-c=m-n B.b-d=m+n
C.a>b>d>c D.a>b>c>d
[解析] 四种离子的“核外电子排布相同”,说明四种离子间存在如下关系:a-m=b-n=c+n=d+m,从而得出a-c=m+n,b-d=m+n,所以A项不正确,B项正确;四种离子的“核外电子排布相同”,还说明四种离子的核电荷数中a、b均大于c、d,又 m>n,这表明aXm+与bYn+中a>b,cZn-与dRm-中c>d,故a>b>c>d,所以C项不正确,D项正确。
[答案] BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com