
题目列表(包括答案和解析)
6.下列分子中所有原子都满足最外层8个电子结构的是( )
A.光气(COCl2) B.六氟化硫
C.二氟化氙 D.三氟化硼
[解析] 逐项分析列表如下:
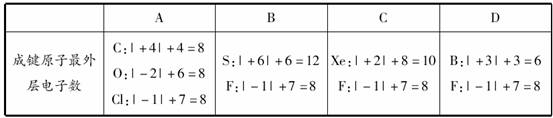
[答案] A
5.下列电子式中,错误的是( )

[解析] 单核阳离子的电子式为离子符号,外围并没有电子(小黑点),A正确;OH-的电子式,要体现共价键O-H中的共用电子对,对于氧元素的外围电子都要表示出,另外电荷符号要加[ ]表示出,B正确;共价分子的电子式,除了表示成键电子外,还要将未成键的外层电子一一用小黑点标出,以体现各原子的稳定结构。C选项中,NH3的电子式应为
[答案] C
4.(2010年南平质检)某分子的球棍模型如下图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
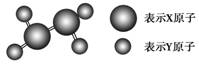
A.X原子可能为ⅤA元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
[解析] X原子通过三对共用电子最外层达到8电子结构,说明X为ⅤA族元素;Y原子通过一对共用电子最外层达到8电子结构,说明Y为ⅦA族元素,故A正确,B错误;X与Y原子间为极性键,X与X原子间为非极性键,故C项正确;由于X原子半径大于Y原子的,该分子为N2F4有可能,D正确。
[答案] B
3.现有如下各种说法:
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子、阴离子的相互吸引力
④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述各种说法正确的是( )
A.①②⑤ B.都不正确
C.④ D.①
[解析] 水中存在分子内的H、O原子之间的相互作用,但也存在分子间的H、O原子相互作用,而化学键只指分子内相邻原子间强烈的相互作用。故①叙述不正确。
不是所有金属和非金属都可形成离子键,只有活泼金属和活泼非金属化合时,才可形成离子键。故②叙述不正确。
在离子化合物中,阴、阳离子间存在相互作用,但不单指吸引力,还有相互排斥力。故③叙述不正确。
HCl分子中不存在离子,它属于共价化合物,分子中没有离子键。故④叙述不正确。
化学反应的本质是旧键断裂、新键形成的过程,但HCl中存在的是共价键而非离子键。故⑤不正确。
[答案] B
2.下列性质中,可以证明其化合物内一定存在离子键的是( )
A.水溶液能导电
B.由金属和非金属元素的原子组成
C.熔融状态能导电
D.可以溶于水
[解析] 在化合物中,只有离子化合物在熔融状态下因电离而导电。
[答案] C
1.下列各组化合物中,化学键的类型相同的是(多选)( )
A.CaCl2和Na2S B.Na2O和Na2O2
C.CO2和CS2 D.HCl和NaOH
[解析] A项中CaCl2和Na2S中都只有离子键;B项中Na2O只有离子键,而Na2O2除有离子键外,还有非极性共价键(过氧根离子中);C项中CO2和CS2中都只有共价键;D项中HCl只有共价键,而NaOH中除有共价键(氢氧根离子中),还有离子键。
[答案] AC
16.(2009年天津高考)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
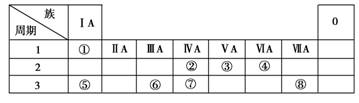
(1)④、⑤、⑥的原子半径由大到小的顺序是________________________________________________________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是__________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________________________________________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3
c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
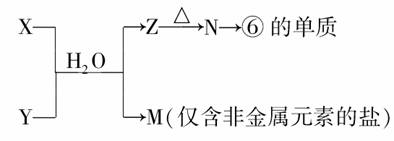
X溶液与Y溶液反应的离子方程式为________________________________________________________________________
____________________________,
N→⑥的单质的化学方程式为________________________________________________________________________,
常温下,为使0.1 mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_______________________。
[解析] 根据各元素在周期表中的位置,推出各元素依次为:
①H、②C、③N、④O、⑤Na、⑥Al、⑦Si、⑧Cl。
(1)Na、Al是第三周期元素,O在第二周期,所以原子半径:Na>Al>O。
(2)因为非金属性:N>C>Si,所以酸性:HNO3>H2CO3>H2SiO3。
(3)H、O、Na、Cl形成的符合条件的物质很多,比较容易写出电子式的有NaOH、NaClO。
(4)该液态物质是H2O2,MnO2、FeCl3可以作H2O2分解的催化剂。
(5)⑥的单质是Al,逆推得N为Al2O3,Z为Al(OH)3;因为M是仅含非金属元素的盐,所以M是铵盐,由此推出X、Y对应的物质是氨水和铝盐,铝盐可能是AlCl3或Al(NO3)3。M可能是NH4Cl或NH4NO3,NH4+可以水解,要使其溶液中M电离的阴、阳离子浓度相等,则根据电荷守恒得c(OH-)=c(H+),即溶液应为中性。
[答案] (1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3

(4)ab
(5)Al3++3NH3·H2O===Al(OH)3↓+3NH4+
2Al2O3(熔融)电解冰晶石4Al+3O2↑ 溶液的pH等于7
(2)已知有机物的种类远远多于无机物,而有机物中含有碳元素,可知ⅣA族元素形成的化合物最多。
(3)根据表可通过分析数据归纳出潜在的规律:
|
周期序数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
元素种数(最多) |
2 2×1 |
8 2×22 |
8 2×22 |
18 2×32 |
18 2×32 |
32 2×42 |
32 2×42 |
可见规律是2n2(n=1,2,3,……),由此预测第八周期元素种数应为2×52,故答案为50。
(4)在周期表中同族元素,从上到下其金属性依次增强,因此,可以确定其单质使水分解放出氢气;其氢氧化物呈现出比氢氧化钙更强的碱性,而不能呈两性。
[答案] (1)第六、七周期中在ⅢB族出现了镧系和锕系
(2)ⅢB ⅣA (3)50 (4)B
15.(2010年金丽衢十二校联考)铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第______周期,第______族。
(2)若设铊的质量数为A,则铊原子中中子数和质子数之差为________。
(3)下列推断正确的是________。
A.单质的还原性:Tl>Al B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3 D.氧化性:Tl3+>Al3+
(4)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag===Tl++2Ag+。下列推断正确的是________。
A.Tl+最外层有1个电子
B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱
D.Tl+的还原性比Ag强
[解析] (1)推断Tl在元素周期表中的位置,可利用各周期的元素种类数(2、8、8、18、18、32)进行分析,81-2-8-8-18-18=27,首先推知该元素位于第六周期,第六周期中镧系有15种元素占一个格,则27-14=13。根据元素周期表的结构可知,第13纵行为第ⅢA族,即Tl在元素周期表中的位置为:第六周期第ⅢA族。
(2)根据A-Z=N,可知铊原子中中子数和质子数之差为(A-Z)-Z,即A-162。
(3)根据元素周期律的递变规律,同主族从上至下,元素金属性逐渐增强,单质还原性增强,原子半径增大,离子氧化性减弱,碱性增强。
(4)铊位于第ⅢA族,说明铊原子最外层有3个电子,则Tl+最外层有两个电子,A错;由Tl3++2Ag===Tl++2Ag+知,Tl3+的氧化性比Ag+强,Ag的还原性比Tl+强,C、D错。
[答案] (1)六 ⅢA (2)A-162 (3)A (4)B
(2)周期表中________族所含元素最多,________族元素形成化合物最多。
(3)请分析周期数与元素种数的关系,然后预测第八周期最多可能含有的元素种数为________。
(4)居里夫人发现的镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是________。
A.在化合物中呈+2价 B.氢氧化物呈两性
C.单质使水分解,放出氢气 D.碳酸盐难溶于水
[解析] 解答此类问题时,应在熟练掌握元素周期表结构的前提下,运用有关递变规律及数学工具来推测知识。
元素周期表是学好化学的有效工具,因此对元素周期表的掌握必须有相当的条理性、严密性,做到对周期表的结构烂熟于心。
13.A、B、C为

短周期元素,在周期表中所处的位置如右图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)A、B、C三种元素的名称分别为 、 、 。
(2)B位于元素周期表中第 周期,第 族。
(3)C的原子结构示意图为 ,C的单质与H2反应的化学方程式为________________________________________________________________________。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式________________________________________________________________________。
[解析] 依题意,A、B、C为短周期元素,从A、B、C的相对位置看,A、C只能处在第二周期,而B处在第三周期。设A的原子序数为x-1,则C为x+1,B为x+8,则有:
(x-1)+x+1=x+8
x=8
所以A、B、C的原子序数分别为7、16、9,对应的元素分别为N、S、F。
[答案] (1)氮 硫 氟 (2)三 ⅥA (3)  F2+H2===2HF
F2+H2===2HF
(4)2NH3+H2SO4===(NH4)2SO4。
完全排满时元素的种数如下表所示:
|
周期序数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
元素种数(最多) |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com