
题目列表(包括答案和解析)
2.钠与水反应时的现象中与钠的下列性质无关的是( )
A.钠的熔点低 B.钠的密度小
C.钠的硬度小 D.有强还原性
[解析] 熔化成小球说明熔点低,浮于水面说明密度小,剧烈反应能置换出H2说明还原性强。
[答案] C
1.按照如右图所示的方法研究某气体的性质,这种方法属于( )
A.实验法 B.观察法
C.分类法 D.比较法
[解析] 观察是一种有计划、有目的地用感官考查研究对象的方法。人们既可以直接用肉眼观察物质的颜色、状态,用鼻子闻物质的气味,也可以借助一些仪器来进行观察。
[答案] B
17.(8分)已知A、B、C、D是中学化学中常见的四种不同多核粒子,它们之间存在如下关系:

(1)如果A、B、C、D均是10电子的粒子,且X为OH-,请写出:A的结构式________,D的电子式________。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,且X为H+,请写出:
①A与B在溶液中反应的离子方程式________________________________________________________________________
________________________________________________________________________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示):________>________。
(3)已知肼(H2N-NH2)和甲胺(H3C-NH2)都是含18个电子的分子,分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式:________________________________________________________________________。
[解析] (1)能与OH-反应的多核10电子微粒主要有NH4+、H3O+、HF等,而HF一旦与OH-反应后生成的F-就是单核微粒了,结合A、B、C、D之间的反应关系可知:A为NH3,B为H3O+,C为NH4+,D为H2O。
(2)18电子多核微粒在酸性条件下转化的有:H2S和HS-,故A为H2S,C为HS-,B为OH-,D为H2O。OH-可夺取H2S中的H+,可见吸H+能力:OH->HS-。
(3)9电子自由基有:-F、-OH、-CH3、-NH2等,两两组合形成的分子均含18个电子。
[答案]
(2)①H2S+OH-===HS-+H2O
②OH- HS-
(3)CH3-CH3(或CH3-OH)
16.(10分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题:
(1)Z的原子结构示意图为________;化合物BA4的电子式为______________。
(2)化合物Y2X2中含有的化学键类型有________(填序号)。
A.离子键 B.极性共价键
C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是____________(填化学式),其主要原因是________________________________________________________________________
________________________________________________________________________。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为________________________________________________________________________。
[解析] Y2X2与水反应生成X单质,其溶液可使酚酞试液变红,则Y为Na,X为O,又X与Z同主族,则Z为S,A、B、X、Y、Z原子序数递增,B与Z最外层电子数之比为2∶3,则B为C,又A与B和X均可形成10电子化合物,则A为H。
(1)化合物BA4为CH4。
(2)Y2X2为Na2O2,既含有离子键又含有非极性共价键。
(3)H2S和H2O相比,H2O沸点高,因为水分子间存在氢键作用。
(4)H2O2具有氧化性,H2S具有强还原性,H2O2与H2S反应生成H2O和S。
[答案]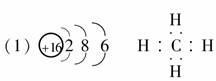
(2)AC (3)H2O 水分子间存在氢键
(4)H2O2+H2S===2H2O+S↓
15.(13分)A、B、C、D、E、F是原子序数依次增大的六种常见元素,其性质如下:
|
元素 |
性质 |
|
A |
单质在C2中燃烧可生成AC和AC2两种气体 |
|
D |
原子的最外层电子与其最内层电子数相同 |
|
E |
单质在C2中燃烧的产物可使品红溶液褪色 |
|
F |
与C元素形成的化合物F3C4具有磁性 |
请回答下列问题:
(1)F元素在周期表中的位置是____________;AC2的电子式为__________。
(2)D单质在空气中燃烧的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)元素C与元素E相比,非金属性较强的是________(用元素符号表示),能证明这一结论的事实是________________________。
(4)A、B、C形成的10电子氢化物中,热稳定性最好的是________(写化学式);B、C的氢化物分子结合H+能力较强的是________(写化学式),用离子方程式加以说明______________________________。
[答案] (1)第4周期Ⅷ族  (2)2Mg+O22MgO,3Mg+N2Mg3N2,2Mg+CO22MgO+C
(2)2Mg+O22MgO,3Mg+N2Mg3N2,2Mg+CO22MgO+C
(3)O 氧的氢化物比硫的氢化物稳定(或S+O2SO2)
(4)H2O NH3 NH3+H3O+===NH4++H2O
14.(9分)元素周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1。
(1)这样的两种元素的组合有________种。
(2)若这样的两种元素形成化合物时原子数之比为1∶2,
①写出这些化合物的化学式:________________________________________________________________________;
②在这些化合物中存在的化学键是________(填“离子键”或“共价键”);
(3)若这样的两种元素形成的化合物中有两种的原子数之比为1∶1。
①写出这两种化合物的化学式和名称:________________________________________________________________________;
②在这两种化合物中存在的化学键是__________________(填“离子键”或“共价键”);
③这两种化合物属于__________(填“离子化合物”或“共价化合物”)。
[解析] (1)设这两种元素分别是M和N,且原子序数M<N,两种元素在元素周期表中的位置关系是:

即这两种元素的组合有7种:①H和Be;②He和B;③O和Na;④F和Mg;⑤Ne和Al;⑥S和K;⑦Cl和Ca。
(2)这样的两种元素的组合只能是③④⑥⑦,它们相互化合时形成的化学键是离子键。
(3)这样的两种元素形成的化合物中有两种的原子数之比为1∶1,对其熟知的是Na2O2,再结合同族元素性质相似的原理进行分析可知,另一种这样的化合物是K2S2。它们都是离子化合物。
[答案] (1)7
(2)①Na2O、K2S、MgF2、CaCl2;②离子键
(3)①Na2O2、过氧化钠 K2S2、过硫化钾 ②离子键、共价键
③离子化合物
13.(12分)下表列出了A-R九种元素在周期表中的位置:
|
主族 |
|
|
|
|
|
|
|
|
|
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
二 |
|
|
E |
|
|
F |
|
|
|
三 |
A |
C |
D |
|
|
|
G |
R |
|
四 |
B |
|
|
|
|
|
H |
|
(1)D、E、R的元素符号分别为________、________、________,其中化学性质最不活泼的是________。
(2)G、H两种元素的最高价氧化物对应的水化物中,酸性最强的是________。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__________。
(4)F元素氢化物的化学式是________,该氢化物在常温下跟B发生反应的化学方程式是________________________________________________________________________。
(5)A、G两种元素的最高价氧化物对应的水化物发生反应的化学方程式是________________________________。
(6)G元素和H元素、A元素和B元素原子的核电荷数之差分别是____________。
[答案] (1)Al B Ar Ar
(2)HClO4 (3)K、Na、Mg (4)H2O
2K+2H2O===2KOH+O2↑
(5)NaOH+HClO4===NaClO4+H2O
(6)18、8
12.

如右图所示是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐 ②Y、Z的气态氢化物的水溶液的酸性:Y<Z
③Z的单质在常温下是液体,可与铁粉反应 ④Z的原子序数比Y大19 ⑤Z所在的周期中含有32种元素
A.①②③④ B.①②③④⑤
C.只有③ D.①④
[解析] 从题中各元素在周期表中所处的位置,得出该图为元素周期表右上角的一部分,由此可以依次判断出各元素:R为He,X为N,Y为S,Z为Br。X的气态氢化物为NH3,而Y的最高价氧化物对应的水化物为H2SO4,它们可反应生成硫酸铵,①正确;Y、Z的气态氢化物分别为H2S、HBr,HBr的水溶液为强酸,H2S的水溶液为弱酸,故②正确;说法③符合客观事实,正确;Z的原子序数为35,而Y的原子序数为16,④正确;Z所在周期为第四周期,从19号元素开始,到36号元素结束,共18种元素,⑤错误。综上所述,正确的答案为A。
[答案] A
11.砷为第四周期VA族元素,根据它在周期表中的位置推测,砷不可能具有的性质是( )
A.砷在通常状况下是固体
B.可以有-3、+3、+5等多种化合价
C.As2O5对应水化物酸性比H3PO4弱
D.砷的还原性比磷弱
[解析] 砷为第四周期ⅤA族元素,第ⅤA族元素最外层有5个电子,可以失去5个电子而呈+5价,也可以得到3个电子而呈-3价,而ⅤA族的N、P除有-3、+5价外,还有+3价;砷在周期表中位于磷的下一周期,磷为固体,可推知砷也为固体;同主族从上到下,最高价氧化物对应水化物的酸性逐渐减弱。故A、B、C项性质可能具有。同主族从上到下元素单质的还原性增强,砷的还原性比磷强。
[答案] D
10.如图是元素周期表中短周期的一部分,B原子与C原子核外电子数之和是A的4倍,则下列推断正确的是( )
A.A、B、C三者均为非金属元素
B.A、B、C三者可以共同形成一种离子化合物
C.A、B、C三者核电荷数之和为32
D.B的氢化物比C的氢化物稳定
[解析] 设A的原子序数为x,则B为x+7,C为x+9。依题意:x+7+x+9=4x,x=8,A、B、C分别是O、P、Cl,三者均为非金属元素,A对;三者之间只能形成共价键,不可能形成一种离子化合物,B错;三者核电荷数之和为8+15+17=40,C错;非金属性C>B,因此氢化物的稳定性C>B,D错。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com