
题目列表(包括答案和解析)
2.0 g·x 200×10-3 L×0.1 mol·L-1
得x=35.75%。
[答案] (1)b
(2)取溶液少量置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠被氧化
(3)Cl2+H2OH++Cl-+HClO,
H++HCO3-===H2O+CO2↑
(4)将尾气通入NaOH溶液中
(5)35.75%
14.某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O
他们设计了如图所示装置制取氯气并验证其性质的实验。
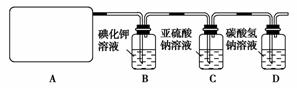
试回答:
(1)该实验中A部分的装置是________(填写装置的序号)。
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):
________________________________________________________________________
________________________________________________________________________。
(3)写出在D装置中发生反应的离子方程式
________________________________________________________________________。
(4)该实验存在明显的缺陷,请你提出改进的方法。
__________________________________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2===Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 20 mL。
则该漂白粉中Ca(ClO)2的质量分数为________。
[解析] (1)实验中A部分应是以漂白粉和硫酸反应制取氯气的装置,根据该反应为固态物质与液态物质在加热条件下制取气体可知,应选b。
(2)检验出C中含有SO42-即可。但要注意SO32-可能产生干扰。
(3)HClO的酸性比H2CO3弱。
(4)实验的设计方案要考虑操作简捷、安全、节约试剂,注意环保等因素。
(5)由反应得出关系式:
Ca(ClO)2-2Cl2-2I2-4Na2S2O3
143 g 4 mol
13.水处理包括水的净化、软化、杀菌消毒、去离子、蒸馏等。其中常见的杀菌消毒剂包括氯气、臭氧、漂粉精、活性炭等。
(1)2008年北京奥运会利用臭氧、活性炭对游泳池进行消毒和净化。下列说法中正确的是( )
A.臭氧、活性炭处理水的原理相同
B.氯气是一种常用的消毒剂,用氯气消毒的水可以用于配制化学试剂
C.漂粉精长期露置在空气中会失效
(2)氯气对饮用水消毒的原理是________________________________________________________________________
________________________________________________________________________。
氯气的消毒能力受水的pH影响,pH小时的消毒能力________(填“>”、“<”或“=”)pH大时的消毒能力,其原因是________________________________________________________________________
________________________________________________________________________。
(3)通常用氯酸钠(NaClO3)与浓盐酸反应来制取ClO2,同时生成Cl2,写出化学方程式________________________________________________________________________
________________________________。
市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4。两种成分在溶液中混合便产生ClO2,反应的化学方程式为________________________________________________________________________。
某同学打算通过研究性学习比较这两种制取ClO2的方法的利弊。要拟定一个简略的研究方案,你认为应该从哪些方向进行研究?
[解析] (1)臭氧利用其强氧化性杀菌,而活性炭利用其吸附性吸附水中杂质,原理不相同;氯气与水反应生成次氯酸和盐酸,可能与所配制的化学试剂发生化学反应,所以不能用氯气消毒的水配制化学试剂;漂粉精的有效成分是次氯酸钙,在空气中发生反应:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,2HClO2HCl+O2↑,故漂粉精失效。
(2)氯气消毒的原理是氯气与水作用产生HClO(具有杀菌、消毒作用)。
[答案] (1)C
(2)Cl2和水反应生成次氯酸:Cl2+H2OHCl+HClO,HClO起杀菌、消毒作用 > 由于HClOH++ClO-,当pH大时,HClO容易转化为ClO-
(3)2NaClO3+4HCl(浓)===Cl2↑+2ClO2↑+2NaCl+2H2O
2NaClO3+Na2C2O4===2ClO2↑+2Na2CO3
原料的包装和运输是否简单易行;pH对消毒能力的影响;制取是否方便;副产物多少;产物对水质的影响;稳定性;安全性等。
2、(3)Ca(HCO3)CaCl2、HClO
12.

饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。某同学应用这一方法,尝试制取HClO溶液并进行了如下定性实验。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液黄绿色褪去。
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强。
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因是________________________________________________________________________
________________________________________________________________________。
(2)写出步骤③中第二份滤液发生反应的离子方程式:
第二份:________________________________________________________________________。
(3)请推测,②的滤液中含有的溶质除了极少量的氯气外,还有 (填化学式)。
[解析] (1)氯水中存在平衡Cl2+H2OHCl+HClO,加入CaCO3后,CaCO3消耗HCl,使上述平衡正向移动。c(HClO)增大,漂白能力增强。
(2)过量CaCO3与HCl发生反应2CaCO3+2HCl===
Ca(HCO3)2+CaCl2,过滤后滤液中存在Ca(HCO3)2。主要是Ca(HCO3)2与盐酸的反应。
(3)由于发生反应2CaCO3+2HCl===Ca(HCO3)2+CaCl2,导致平衡Cl2+H2OHClO+HCl正向移动,因此溶液中除生成Ca(HCO3)2、CaCl2外,还有HClO。
[答案] (1)CaCO3消耗了氯水中的HCl,使平衡Cl2+H2OHCl+HClO向正反应方向移动,c(HClO)增大
(2)HCO3-+H+===CO2↑+H2O
11.下列是治疗口腔炎症的药物华素片(西地碘片)的部分使用说明:
|
使用说明书 |
|
|
主要成分 |
活性分子碘含量:1.5 mg/片 |
|
贮藏 |
遮光、密闭、在阴凉处保存 |
|
有效期 |
二年 |
请根据上述说明回答:
(1)推断华素片________(填“是”或“不是”)白色。
(2)某同学欲证实该药片中确定含有分子碘,设计并完成如下实验:①将药片研碎、溶解、过滤,所得滤液分装于甲、乙两试管中备用。
②在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,上层液体颜色为________色,所加试剂为下列中的______________,由此说明分子碘的存在。
A.苯 B.酒精
C.四氯化碳 D.盐酸
③在乙试管中滴加________溶液,溶液变蓝色,也说明了分子碘的存在。
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如下转化关系:
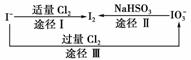
①如以海水为原料制取I2,加的Cl2要适量,如过量就会发生途径Ⅲ的副反应。在该反应产物中,IO3-与Cl-物质的量之比为1∶6,则氧化剂和还原剂物质的量之比为__________。
②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应离子方程式是______________________________________。
[解析] (1)碘单质是紫黑色固体。(2)I2难溶于水,易溶于苯或四氯化碳,苯的密度比水小,四氯化碳的密度比水大。(3)①3Cl2+I-+3H2O===6Cl-+IO3-+6H+;②注意HSO3-不可拆分。
[答案] (1)不是 (2)②紫红(或浅紫) A(或C) ③淀粉
(3)①3∶1 ②2IO3-+5HSO3-===5SO42-+H2O+3H++I2
10.某化工厂生产的漂白粉,产品说明书如下:
漂白粉使用说明书
[主要成分]次氯酸钙,氯化钙
[用法用量]每次取漂白粉2 g,水1 000 mL,配成0.2%-0.3%的浊液。
将病人用具浸泡其中5-10分钟,如需要,浓度可提高,时间可延长。
[注意事项]………
请你回答:
(1)请你为漂白粉写一份保存、使用的注意事项(不超过30字)。
________________________________________________________________________
________________________________________________________________________。
(2)用化学方程式表示:
①漂白粉的生产原理:________________________________________________________________________;
②一般情况下,漂白粉失效的主要原因:________________________________________________________________________
________________________________________________________________________。
[答案] (1)密封、避光保存在阴凉处,随配随用,不要接触皮肤,不能用以漂洗丝、毛织品等
(2)①2Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O
②Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,
2HClO2HCl+O2↑
9.将0.03 mol Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中,在此过程中,溶液c(H+)与Cl2用量(物质的量n)的关系示意图是下图中的(溶液体积视为不变)( )
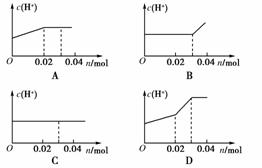
[解析] 原溶液中由于溶有H2SO3和HBr,故c(H+)>0;H2SO3的还原性大于HBr的,通入Cl2时先发生反应Cl2+H2SO3+H2O===4H++2Cl-+SO42-,随Cl2的通入,c(H+)增大,到通入0.02 mol Cl2时上述反应恰好完全反应,之后发生Cl2+2Br-===2Cl-+Br2,此时c(H+)几乎不变。
[答案] A
8.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以碘酸钾(KIO3)形式存在。已知在酸性溶液中IO3-可和I-发生反应:IO3-+5I-+6H+===3I2+3H2O。根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是( )
A.①③ B.③⑥
C.②④⑥ D.①②④⑤⑦
[解析] 食盐中碘以碘酸钾形式存在,溶于水以IO3-形式存在。依题意:IO3-+5I-+6H+===3I2+3H2O;检验IO3-要求现象明显。结合I2的特殊性(遇淀粉变蓝),只需在酸性(H+)条件下加入I-,生成的I2用淀粉检验,故选B。
[答案] B
7.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用如下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
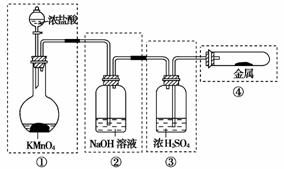
A.①和②处 B.只有②处
C.②和③处 D.②、③、④处
[解析] ①是制备氯气的装置 ②是除去氯气中氯化氢的装置 ③是干燥装置 ④是氯气与金属反应的装置。不能用NaOH溶液除去Cl2中的HCl,应用饱和食盐水,②处错误;③中应是长管进气,短管出气,所以③处错误;④是封闭体系,Cl2不能通入④中,故④处错误。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com