
题目列表(包括答案和解析)
4.在硫化氢的水溶液中,存在以下平衡:H2S HS-+H+,HS-
HS-+H+,HS- S2-+H+若使溶液的pH减小,则[S2-]( )
S2-+H+若使溶液的pH减小,则[S2-]( )
A.增大 B.减小
C.不变 D.可能增大也可能减小
[解析] 考查弱电解质电离平衡移动相关的若干知识,如加入CuSO4溶液,S2-浓度减小,pH减小,若通入H2S至饱和,则pH减小,S2-浓度增大。
[答案] D
3.相同温度下,下列各物质导电能力最强的是( )
A.1 000 mL,0.1 mol·L-1KOH
B.2 L,0.1 mol·L-1CH3COOH
C.100 mL,0.1 mol·L-1HF
D.100 mL,0.1 mol·L-1K2SO4
[解析] 电解质溶液导电性强弱决定于溶液中自由移动离子浓度的大小,与溶液中体积大小无关。自由移动离子浓度相同时,再比较电荷的高低电荷高的导电能力强。
[答案] D
2.下列电离方程式错误的是( )
A.NaHS溶于水:NaHS===Na++HS-,HS-+H2O H3O++S2-
H3O++S2-
B.Al(OH)3电离:Al(OH)3 Al3++3OH-;Al(OH)3+H2O
Al3++3OH-;Al(OH)3+H2O [Al(OH)4]-+H+
[Al(OH)4]-+H+
C.(NH4)2SO4溶于水:(NH4)2SO4 2NH4++SO42-
2NH4++SO42-
D.HF溶于水:HF+H2O H3O++F-
H3O++F-
[解析] 注意A、D项中H+和H3O+的关系。
[答案] C
1.下列物质仅能在水溶液中导电的物质是( )
A.NaOH B.NaHSO4
C.HCl D.CH3CH2OH
[解析] NaOH、NaHSO4属于离子化合物,在熔融状态下也能导电;CH3CH2OH是非电解质,在水溶液或熔融状态下均不能导电;HCl是共价化合物,只能在水溶液中导电。
[答案] C
16.(14分)镁是一种轻金属,其合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水矿物质中镁的浓度仅次于氯和钠,居第三位。由于对镁的需求非常巨大,很多沿海国家都建有大型海水提镁工厂。
下表是有关物质的Ksp:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10-9 |
6.8×10-6 |
5.5×10-6 |
1.8×10-11 |
回答下列问题:
(1)能否直接把贝壳研磨成粉末,撒入海水中使Mg2+转化为MgCO3沉淀,其原因是_________________________________________________________________________________。
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,其理由是________________________________________________________________________;
请你推测应将贝壳进行怎样的加工处理_________________________________________________________________________________。
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他________(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是_________________________________________________________________________________。
(4)过滤出Mg(OH)2沉淀后,用试剂________(填化学式)将其溶解,选择该试剂的理由是____________________________________
________________________________________________________________________。
[解析] (1)CaCO3和MgCO3化学式所表示的组成中阴、阳离子个数比相同,从Ksp看,CaCO3的溶解能力比MgCO3的小,所以不能直接加贝壳粉末使Mg2+转化为MgCO3沉淀;
(2)MgCO3的溶度积比Mg(OH)2的溶度积大,所以应把Mg2+转化为Mg(OH)2沉淀,即把贝壳研磨、煅烧、加水制成石灰乳[Ca(OH)2];
(3)根据沉淀的转化,烧碱电离产生的OH-能结合MgCO3溶解产生的Mg2+生成溶解度更小的Mg(OH)2沉淀,使MgCO3的溶解平衡不断向右移动;
(4)盐酸电离的H+与Mg(OH)2溶解产生的OH-生成水,使Mg(OH)2的溶解平衡不断右移。
[答案] (1)不能,MgCO3的溶解度比CaCO3溶解度大,直接加贝壳粉末得不到MgCO3沉淀
(2)为使Mg2+沉淀完全,应将Mg2+转化为溶解度更小的Mg(OH)2 研磨、煅烧、加水制成石灰乳
(3)能 烧碱电离产生的OH-能结合MgCO3溶解产生的Mg2+生成溶解度更小的Mg(OH)2沉淀,使MgCO3的溶解平衡不断向右移动
(4)HCl 盐酸电离的H+与Mg(OH)2溶解产生的OH-生成水,使Mg(OH)2的溶解平衡不断右移
15.(10分)某研究性学习小组的同学拟从多角度研究碳酸钠和碳酸氢钠的性质及其溶液中微粒间的关系,请参与探究并回答相关问题。
(1)下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是________。
A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫
C.厨房中常用碳酸钠溶液洗涤餐具上的油污
D.可用碳酸钠与醋酸制取少量二氧化碳
(2)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示,下列说法正确的是______。

A.0.1 mol·L-1Na2CO3 溶液中[Na+]/[CO32-]=2
B.加入盐酸使溶液pH为10时的混合液中,碳元素以CO32-和HCO3-形式存在
C.当混合液的pH<7时,开始放出CO2气体
D.常温下0.05 mol·L-1NaHCO3溶液,pH=9
(3)现有pH试纸、温度计、石蕊试液、酚酞、蒸馏水以及必要的实验仪器,试设计一个简单的实验,证明在碳酸氢钠溶液中存在着HCO3-+H2O H2CO3+OH-的水解平衡____________________________________________________________________________________________________________________________(要求写出简要操作,现象及实验能说明的问题)。
H2CO3+OH-的水解平衡____________________________________________________________________________________________________________________________(要求写出简要操作,现象及实验能说明的问题)。
[解析] (1)A是因为碳酸钠水解显碱性与玻璃中的二氧化硅作用生成黏性的Na2SiO3;B是因为发生双水解:Al3++3HCO3-===Al(OH)3↓+3CO2↑;C是因为CO32-水解显碱性,能去除油污。(2)选项A,碳酸根水解而使[Na+]/[CO32-]>2;由图可知,B正确;C不正确,由图知开始生成的二氧化碳先转变为H2CO3,pH约为6时,才有CO2放出;D不正确,由CO32-+H+===HCO3-,当滴加20 mL盐酸时,刚好生成碳酸氢钠,此时碳酸氢钠溶液为0.05 mol·L-1,再从图上读得,此时溶液的pH=8。(3)依据水解反应是吸热反应的原理进行设计。
[答案] (1)D (2)B
(3)在碳酸氢钠溶液中滴入酚酞试液,溶液呈浅红色,将溶液微热,溶液红色加深。水解反应是吸热反应,加热平衡向水解方向移动,[OH-]增大,故其中存在水解平衡
14.(14分)(2010年临沂质检)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵⑦硫酸氢铵 ⑧氨水,请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______________。
(2)④⑤⑥⑦⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)____________________。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________。
(4)已知t ℃时,KW=1×10-13,则t ℃(填“>”“<”或“=”)________25 ℃。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
[解析] (1)加酸、加碱均会抑制水的电离,加入可以水解的盐促进水的电离,所以由水电离出H+浓度由大到小顺序为④②③①。
(2)铵盐为强电解质,完全电离,氨水为弱电解质,部分电离,所以铵盐中NH4+的浓度大于氨水中NH4+的浓度。CH3COO-对NH4+水解是促进作用,NH4HSO4电离出的H+对NH4+水解是抑制作用,故NH4+浓度⑦>⑤。综合以上信息NH4+浓度由大到小的顺序是⑥⑦④⑤⑧。
(3)③④等体积混合后为等浓度NaCl和NH3·H2O的混合液,故离子浓度大小为[Na+]=[Cl-]>[OH-]>[NH4+]>[H+]。
(4)t ℃时,KW=1×10-13,大于常温下水的离子积,故t ℃>25 ℃。混合后溶液呈酸性,故[H+]==10-2,得=。
[答案] (1)④②③① (2)⑥⑦④⑤⑧
(3)[Cl-]=[Na+]>[OH-]>[NH4+]>[H+]
(4)> 9∶2
13.(14分)有一个七只杯子魔术实验,非常有趣,杯中的试剂不同或试剂的量不同,通过发生氧化还原反应或酸碱反应,因pH及所用指示剂不同,而显示不同的颜色。七只杯子中的药品、实验步骤及转移次序如下图所示:
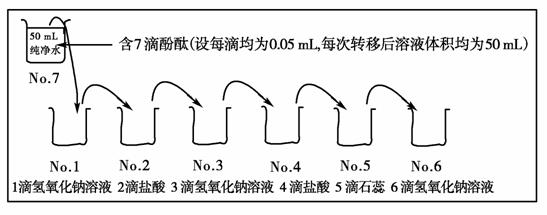
试回答下列问题:
(1)若盐酸和氢氧化钠溶液的浓度均为0.1 mol·L-1,1-5号杯子中依次出现的颜色是:
|
杯号 |
1 |
2 |
3 |
4 |
5 |
6 |
|
颜色 |
|
|
|
|
|
蓝紫色 |
当液体进入时,哪个杯中水的电离度最大?________(选填1-6号,下同);哪个杯中水的电离度最小?________。
(2)若2号杯显无色,4号杯显无色,5号杯显红色,则[NaOH]与[HCl]的关系是________________________________________________________________________。
[解析] (1)溶液进入1号杯时,[OH-]=0.1 mol·L-1×0.05×10-3 L÷(50×10-3 L)=10-4 mol·L-1,pH=10;进入2号杯时氢氧化钠被中和,且盐酸剩余,相当于过量1滴盐酸,此时溶液中[H+]=0.1 mol·L-1×0.05×10-3 L÷(50×10-3 L)=10-4 mol·L-1,pH=4;3号杯,[OH-]=2×10-4 mol·L-1,[H+]=5×10-11 mol·L-1,pH=10.3;4号及5号杯,[H+]=2×10-4 mol·L-1,pH=3.7;6号杯中,由于共用了NaOH溶液1+3+6=10滴,共用了盐酸2+4=6滴,相当于过量了4滴NaOH溶液,[OH-]为1号溶液的4倍,即[OH-]=4×10-4 mol·L-1,[H+]=2.5×10-11 mol·L-1,pH=10.6。由于H+和OH-能同等程度抑制水的电离,故水的电离度最大的是1号和2号,此时由水电离的[H+]或[OH-]为10-10 mol·L-1;水的电离度最小的是6号,水电离的[H+]或[OH-]为2.5×10-11 mol·L-1。
(2)由于2号杯显无色,说明pH<8即[OH-]<10-6 mol·L-1;由于4号和5号溶质相同,4号显无色,说明pH<8,5号显红色,说明是石蕊显色,pH<5,即[H+]>10-5 mol·L-1。设盐酸和NaOH溶液的物质的量浓度分别为a mol·L-1、b mol·L-1,在2号杯中,应用(0.05b-2×0.05a)÷50<10-6,即b<2a+0.001,在5号杯中,(6×0.05a-4×0.05b)/50>10-5,求得b<1.5a-0.002 5,故综合起来,有b<1.5a-0.002 5。
[答案] (1)红色 无色 红色 无色 红色 1号和2号 6号
(2)[NaOH]<1.5[HCl]-0.002 5 mol·L-1
12.某二元酸(H2A)按下式发生电离:H2A===H++HA-;HA- H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl溶液与0.04 mol·L-1的NaHA溶液等体积混合
④0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是( )
A.溶液②中存在水解平衡:HA-+H2O H2A+OH-
H2A+OH-
B.溶液③中有:[HA-]+2[A2-]=[Na+]
C.溶液④中有:[OH-]>[H+]+[HA-]
D.四种溶液中[HA-]浓度大小:③>①>②>④
[解析] 由于酸H2A第一步是完全电离的,所以在溶液②中HA-不会发生水解反应,A错。经反应后③溶液是等物质的量浓度的H2A、NaHA和NaCl的混合溶液,由于H2A第一步是完全电离的,根据物料守恒有[HA-]+[A2-]=[Na+],B错。经反应后溶液④为Na2A溶液,由于H2A第一步是完全电离的,根据质子守恒可得[OH-]=[H+]+[HA-],C错。
[答案] D
11.(2010年深圳调研)国家环境保护总局网公布了“141种高污染、高环境风险”产品名录,包括43号氰化钠、46号氢氰酸、55号高氯酸铵、57号硫化钠等。下列说法不正确的是( )
A.已知常温下0.1 mol·L-1NaCN溶液的pH=12,则已水解的CN-约占总数的10%
B.已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
C.NH4ClO4溶液中,[ClO4-]>[NH4+]>[OH-]>[H+]
D.欲使0.1 mol·L-1Na2S溶液中[Na+]/[S2-]更接近2,可加入适量KOH
[解析] 由CN-+H2O HCN+OH-,故已水解的[CN-]=[OH-]=10-2 mol·L-1,水解率为10-2
mol·L-1/0.1 mol·L-1×100%=10%,故A正确;NH4CN显碱性说明水解程度CN->NH4+,从而说明NH3·H2O比HCN易电离,故B正确;C不正确,高氯酸铵是强酸弱碱盐,水溶液显酸性,[H+]>[OH-];D正确,加入KOH可抑制Na2S水解。
HCN+OH-,故已水解的[CN-]=[OH-]=10-2 mol·L-1,水解率为10-2
mol·L-1/0.1 mol·L-1×100%=10%,故A正确;NH4CN显碱性说明水解程度CN->NH4+,从而说明NH3·H2O比HCN易电离,故B正确;C不正确,高氯酸铵是强酸弱碱盐,水溶液显酸性,[H+]>[OH-];D正确,加入KOH可抑制Na2S水解。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com