
题目列表(包括答案和解析)
9.(2010年湛江质检)常温时,以下4种溶液pH最小的是( )
A.0.01 mol·L-1醋酸溶液
B.0.02 mol·L-1醋酸与0.02 mol·L-1NaOH溶液等体积混合液
C.0.03 mol·L-1醋酸与0.01 mol·L-1NaOH溶液等体积混合液
D.pH=2的盐酸与pH=12的NaOH溶液等体积混合液
[解析] B项恰好生成CH3COONa溶液,pH>7,D项恰好生成NaCl溶液,pH=7,只有A、C项pH<7,C项反应后得到0.01 mol/L的醋酸与0.005 mol/L醋酸钠的混合液,CH3COO-离子抑制CH3COOH的电离,所以[H+]小于A项中的溶液。
[答案] A
8.下列公式中哪一个能用来精确地计算任意浓度的盐酸溶液中的氢离子浓度[H+](KW为水的离子积常数)( )
A.[H+]=[HCl]
B.[H+]=[HCl]+KW/[H+]
C.[H+]=[HCl]+KW
D.[H+]=[HCl]-KW/[H+]
[解析] 盐酸溶液中的H+包含盐酸提供的H+和H2O电离产生的H+,盐酸电离产生的H+浓度等于盐酸的浓度,根据KW=[H+]·[OH-],H2O电离产生的H+浓度等于H2O电离产生的OH-浓度,故溶液中的[H+]=[HCl]+KW/[H+]。
[答案] B
0.5×10-5 mol·L-1÷500)∶1×10-7 mol·L-1=1∶10
[答案] C
7.常温下将pH为5的硫酸稀释500倍,稀释后溶液中[SO42-]和[H+]之比为( )
A.1∶1 B.1∶2
C.1∶10 D.10∶1
[解析] 酸性溶液被水稀释时,[H+]的变化对水的电离会产生影响。酸被稀释后,[H+]酸==2×10-8 mol·L-1<1×10-7 mol·L-1,而溶液不会变成碱性,故计算溶液中的[H+]方法应该如下:设由水电离产生的[H+]=x,则溶液中的[H+]总=2×10-8 mol·L-1+x,由
H2O H+ + OH-
H+ + OH-
2×10-8+x x
KW=[H+]·[OH-]=(2×10-8+x)·x
=1×10-14 mol·L-1
解得x≈1×10-7 mol·L-1
那么[SO42-]和[H+]之比约为:
6.下列溶液一定呈中性的是( )
A.pH=7的溶液
B.[H+]=[OH-]的溶液
C.由强酸、强碱等物质的量反应得到的溶液
D.非电解质溶于水得到的溶液
[解析] 当溶液中[H+]=[OH-]时,溶液一定呈中性,B项正确;由于水的电离受温度影响,不同温度下,纯水的pH不同,pH=7时不一定呈中性,A项错误;强酸强碱的元数不同时,即使等物质的量混合,也不能恰好完全中和,C项错误;SO2、SO3等均为非电解质,其水溶液为酸性溶液,D项错误。
[答案] B
5.根据生活经验,判断下列物质按酸碱性的一定顺序依次排列正确的是( )
A.醋、厕所清洁剂、肥皂、厨房清洁剂
B.厕所清洁剂、厨房清洁剂、醋、肥皂
C.厕所清洁剂、醋、肥皂、厨房清洁剂
D.厨房清洁剂、醋、肥皂、厕所清洁剂
[解析] 厕所清洁剂一般用来除水垢和污物,水垢的主要成分是CaCO3,所以应该是较强的酸性溶液;醋呈酸性,一般酸性较弱;厨房清洁剂一般用于除油污,所以溶液呈碱性,而肥皂水也显碱性,但厨房清洁剂碱性更强一些。
[答案] C
4.(2010年南京调研)25 ℃时,某溶液中由水电离出来的并游离存在于溶液中的[H+]=1×10-a mol·L-1。
①若a>7时,此溶液中水的电离一定受到抑制
②若a<7时,此溶液中水的电离一定受到了促进
③若a>7时,此溶液pH为a或14-a
④若a<7时,此溶液pH为a或14-a
上述说法正确的是( )
A.①② B.②③
C.③④ D.①④
[解析] 若a>7时,此时溶液中的[H+]=1.0×10-a mol·L-1或[OH-]=1.0×10-(14-a) mol·L-1,所以水的电离可能受到抑制也可能受到促进,①错误;若a<7时,此溶液中[H+]=1.0×10-a mol·L-1,水的电离一定受到了促进,此时pH=a,所以②正确,④错误;a>7时此溶液可能为酸溶液,也可能为碱溶液,溶液pH=a或pH=14-a,③正确。
[答案] B
3.25 ℃时,水的电离达到平衡:H2O
H++OH- ΔH>0,下列叙述正确的是( )
A.将水加热到90 ℃,pH不变
B.向水中加入CH3COONa固体,pH变小
C.向水中加入稀氨水,KW变大
D.向水中加入少量固体硫酸氢钠,KW不变
[解析] 选项A,H2O的电离是吸热过程,加热能促进H2O的电离,纯水中[H+]增大,pH减小。选项B,CH3COO-水解促进H2O的电离,溶液中[OH-]增大,pH增大。KW与温度有关,与溶液的酸碱性无关,加入少量稀氨水或NaHSO4后溶液的KW均不变。
[答案] D
2.将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
[解析] H2O H++OH-,水的电离过程为吸热过程,升高温度使电离平衡向电离方向移动。[H+]和[OH-]均增大,KW增大,pH减小,但纯水中[H+]=[OH-],呈中性。
H++OH-,水的电离过程为吸热过程,升高温度使电离平衡向电离方向移动。[H+]和[OH-]均增大,KW增大,pH减小,但纯水中[H+]=[OH-],呈中性。
[答案] D
1.对H2O的电离平衡不产生影响的粒子是( )
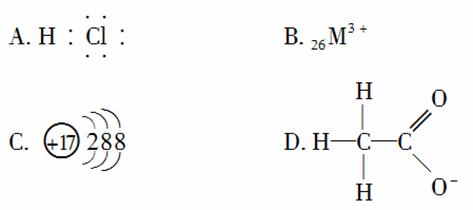
[解析] A项HCl溶于水电离出H+会抑制水的电离;B项的Fe3+,D项中的CH3COO-都会水解,促进水的电离;C项的Cl-不水解,不影响水的电离平衡。解本题时,首先要知道各选项分别表示什么微粒,既能“识记”,同时也要会“再现”。规范书写,准确运用化学用语是准确答题的关键。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com