
题目列表(包括答案和解析)
2.为了说明盐类水解是吸热反应,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是( )
A.将CH3COONa·3H2O晶体溶于水,温度降低
B.醋酸钠溶液的pH大于7
C.醋酸钠溶液滴入酚酞显红色,加热后颜色变深
D.醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气
[解析] 晶体溶解过程也有热效应,不能确定是水解吸热造成的;B项只能说明醋酸根离子发生了水解;C项给醋酸钠溶液加热,溶液红色加深,说明碱性增强,可证明升高温度醋酸水解平衡向右移动,即水解是吸热反应;D项说明醋酸是挥发性酸。
[答案] C
1.下列物质的溶液中,所含离子种类最多的是( )
A.Na2S B.Na3PO4
C.Na2CO3 D.AlCl3
[解析] Na3PO4所含离子种类最多,因它的水解有三级:
PO43-+H2O HPO42-+OH-
HPO42-+OH-
HPO42-+H2O H2PO4-+OH-
H2PO4-+OH-
H2PO4-+H2O H3PO4+OH-
H3PO4+OH-
再加水的电离H2O H++OH-,所以磷酸钠溶液中,除Na+外还有五种离子:PO43-、HPO42-、H2PO4-、H+、OH-。
H++OH-,所以磷酸钠溶液中,除Na+外还有五种离子:PO43-、HPO42-、H2PO4-、H+、OH-。
[答案] B
16.草酸晶体的组成可表示为:H2C2O4·xH2O,为测定x值,进行下列实验。
①称取m g草酸晶体,配成100.0 mL溶液。
②取25.0 mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1 KMnO4溶液滴定。滴定时,所发生反应为:
2KMnO4+5H2C2O4+3H2SO4===K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和____________、____________、____________。
(2)在实验②中,滴定时KMnO4溶液应装在________式滴定管中,原因是________________________________________。
(3)在滴定过程中,目光应注视______________________,判断滴定结束的标准是______________________________________。
(4)若滴定时,反应前后两次读数分别为a和b,则实验所配得的草酸溶液的物质的量浓度为________________,因此计算出草酸晶体x值为________________。
(5)若读取读数a时仰视,读取读数b时俯视,则所测x值________(填“偏大”、“偏小”或“不变”)。
[解析] 在反应中,2KMnO4-5H2C2O4,有别于中和滴定中H+-OH-;另外,由于KMnO4本身有色(紫色),被完全还原成Mn2+(近乎无色)后,有显著颜色变化,故无需外加指示剂。
(1)配制时还需玻璃棒、100 mL容量瓶、胶头滴管。
(2)由于KMnO4是强氧化剂,和酸一样也能使橡胶管氧化、老化、开裂,故只能装在酸式滴定管中。
(3)目光应注视锥形瓶中溶液颜色的变化,以准确判断滴定终点。终点时,KMnO4和H2C2O4恰好完全反应,若再多加一滴(或半滴)KMnO4,溶液呈紫色,紫色在30 s内不褪色,表明达到了滴定终点,若30 s之后褪色,可能是空气中还原剂还原KMnO4引起的,不影响测定结果。
(4)2KMnO4 - 5H2C2O4
2 5
(b-a)mL·c mol·L-1 25.0 mL·[H2C2O4]
则[H2C2O4]=
=·c·(b-a)mol·L-1
依题可列方程:
=0.100 0 L×c·(b-a)mol·L-1
解得x=-5
(5)开始时仰视,读数a偏大,结束时俯视,读数b偏小,则(b-a)值偏小,代入(4)中x表达式可知x值偏大。
[答案] (1)玻璃棒 100 mL容量瓶 胶头滴管
(2)酸 KMnO4具有强氧化性,会腐蚀碱式滴定管的橡胶管
(3)锥形瓶中溶液颜色的变化 加入最后一滴(半滴)KMnO4溶液,溶液呈紫色,且30 s内不褪色
(4)c(b-a)mol·L-1 -5
(5)偏大
0.01 mol/L×a L=0.1 mol/L×b L
a∶b=10∶1
离子浓度关系:[Na+]>[SO42-]>[H+]=[OH-]
(2)若pH=2,则
[H+]混==0.01 mol/L
a∶b=9∶2
离子浓度关系:此时,假如原来NaOH溶液为9 L、H2SO4溶液则为2 L
n(Na+)=0.01 mol/L×9 L=0.09 mol
剩余n(H+)=0.01 mol/L×(9 L+2 L)=0.11 mol
n(SO42-)=×2 L=0.1 mol
所以:[H+]>[SO42-]>[Na+]>[OH-]
[答案] 大于 KW随温度升高而增大
(1)10∶1 [Na+]>[SO42-]>[H+]=[OH-]
(2)9∶2 [H+]>[SO42-]>[Na+]>[OH-]
15.某温度(t ℃)时,水的离子积为KW=1×10-13mol2·L-2,则该温度(填“大于”、“小于”或“等于”)______25 ℃,其理由是_____。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是____________________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是________________________________。
[解析] KW随温度升高而增大,本题温度为高于25 ℃。
(1)H2SO4中,[H+]=0.1 mol/L,则NaOH溶液中
[OH-]==0.01 mol/L
14.室温时,将pH=5的硫酸稀释10倍,则[H+]∶[SO42-]=________。若将稀释后的溶液再稀释100倍,则[H+]∶[SO42-]=________。
[解析] pH=5时,[H+]=10-5mol/L,[SO42-]=mol/L。稀释10倍后,[H+]=10-6mol/L,[SO42-]=mol/L,所以为2∶1。再稀释100倍,[H+]=10-7mol/L(极限),[SO42-]=mol/L=5×10-9mol/L,所以为20∶1。
[答案] 2∶1 20∶1
13.中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+的浓度来测定溶液的pH。已知100 ℃时,水的离子积常数KW=1×10-12。
(1)已知水中存在如下平衡:H2O+H2O H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是________(填字母)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是________(填字母)。
A.向水中加入NaHSO4 B.向水中加入Cu(NO3)2
C.将水加热至100 ℃ D.在水中加入(NH4)2SO4
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显________色,溶液呈________性(填“酸”、“碱”或“中”);若用pH计测定,则pH________7(填“>”、“=”或“<”),溶液呈________性(填“酸”、“碱”或“中”)。
[解析] (1)题中要求使水的电离平衡向右移动,即促进水的电离,常采用加热法或加入可水解的盐,现同时要求溶液呈酸性,因此只能加入强酸弱碱盐。
(2)100 ℃时水的pH=6,但溶液仍呈中性,因此pH试纸仍为黄色。
[答案] (1)BD (2)黄 中 < 中
12.(2010年绍兴质检)今有室温下四种溶液,有关叙述正确的是( )
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①②中分别加入适量的氯化铵晶体后,①溶液的pH减小,②溶液的pH不变
B.温度下降,①②③④四种溶液的pH均不变
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.①④两溶液等体积混合,所得溶液中:[Cl-]>[NH4+]>[H+]>[OH-]
[解析] ①②加入NH4Cl后,①溶液中NH4+抑制NH3·H2O的电离,[OH-]减小,pH减小,②溶液中,NH4+与OH-结合,使[OH-]减小,pH也减小,A项错误;温度下降,KW与弱电解质的电离平衡均受影响,故除④外,①②③的pH都要变化,B项错误;①④等体积混合后,由于二者pH之和等于14,所以氨水过量,溶液呈碱性,离子浓度大小关系应为[NH4+]>[Cl-]>[OH-]>[H+],D项错误。
[答案] C
11.在t ℃时,某Ba(OH)2的稀溶液中[H+]=10-a mol/L,[OH-]=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.3 B.4
C.5 D.6
[解析] Ba(OH)2溶液的pH=8,即a=8,再根据a+b=12,则b=4,该温度下KW=10-12;当恰好完全中和时,溶液的pH=6,显中性。即加盐酸的体积为22.0 mL时,恰好完全中和,根据[H+]×22.0 mL=[OH-]×22.0 mL,又[OH-]=10-4 mol/L,则盐酸[H+]=10-4 mol/L,pH=4。
[答案] B
10.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如下图所示从下表中选出正确选项(多选)( )
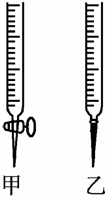

[解析] 解答本题的关键是:①明确酸、碱式滴定管使用时的注意事项,②指示剂的变色范围。
酸式滴定管不能盛放碱性溶液,而碱式滴定管不能盛放酸性溶液,指示剂应选择颜色变化明显的酚酞或甲基橙,不能选用石蕊。另外还要注意在酸碱中和滴定中,无论是标准溶液滴定待测溶液,还是待测溶液滴定标准液,只要操作正确,都能得到正确的结果。
[答案] CD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com