
题目列表(包括答案和解析)
0.04 L×0.2 mol/L 0.04 L×0.1 mol/L
余n[Ba(OH)2)]=0.004 mol,n(OH-)=0.008 mol
[OH-]=0.1 mol/L
则pH=13。
[答案] Ⅰ.BaCO3+2H+===Ba2++H2O+CO2↑
Ⅱ.(1)B (2)5.5×10-10 2.2×10-10 (3)13
14.利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段称为钡餐透视。
Ⅰ.医学上进行钡餐透视时为什么不用BaCO3?(用离子方程式表示)________________。
Ⅱ.某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:①5 mL水,②40 mL 0.2 mol/L的Ba(OH)2溶液,③20 mL 0.5 mol/L的Na2SO4溶液,④40 mL 0.1 mol/L的H2SO4溶液中,溶解至饱和。
(1)以上各溶液中,Ba2+的浓度由大到小的顺序为( )
A.②>①>③>④ B.②>①>④>③
C.①>④>③>② D.①>②>④>③
(2)已知298 K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液②中的SO42-浓度为________mol/L,溶液③中Ba2+的浓度为________mol/L。
(3)某同学取同体积的溶液②和溶液④直接混合,则混合液的pH为________(设混合溶液的体积为混合前两溶液的体积之和)。
[解析] Ⅰ.因BaCO3能与酸反应生成Ba2+使人体中毒,故不能用来作钡餐。
Ⅱ.(1)①中[Ba2+]==1.0×10-5 mol/L
②中[Ba2+]=0.2 mol/L
③中[SO42-]=0.5 mol/L
[Ba2+]=2.2×10-10 mol/L
④中[SO42-]=0.1 mol/L
[Ba2+]=1.1×10-9 mol/L
故Ba2+的浓度由大到小顺序为②①④③。
(2)Ksp(BaSO4)=[Ba2+]·[SO42-]
[SO42-]==5.5×10-10 mol/L
[Ba2+]==2.2×10-10 mol/L
(3)中和反应后Ba(OH)2剩余,
Ba(OH)2 + H2SO4===BaSO4↓+2H2O
13.牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(固) 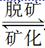 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_________________________________________________________________________________。
(2)已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚硬。请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因是____________________________________。
(3)根据以上原理,请你提出一种其他促进矿化的方法:__________________。
[解析] 根据题意,牙齿表面有一层硬的物质存在如下平衡:Ca5(PO4)3OH(固) 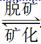 5Ca2++3PO43-+OH-,进食后产生有机酸,电离出H+与OH-结合生成H2O,破坏上述平衡使其向脱矿方向移动,牙齿受到腐蚀。当用含氟牙膏刷牙时,5Ca2++3PO43-+F-===Ca5(PO4)3F↓,产生了质地更坚硬的固体物质,使牙受到保护。从Ca5(PO4)3OH在唾液中的平衡可以看出,加入Ca2+或加入PO43-都可促进矿化。
5Ca2++3PO43-+OH-,进食后产生有机酸,电离出H+与OH-结合生成H2O,破坏上述平衡使其向脱矿方向移动,牙齿受到腐蚀。当用含氟牙膏刷牙时,5Ca2++3PO43-+F-===Ca5(PO4)3F↓,产生了质地更坚硬的固体物质,使牙受到保护。从Ca5(PO4)3OH在唾液中的平衡可以看出,加入Ca2+或加入PO43-都可促进矿化。
[答案] (1)生成的有机酸能中和OH-:H++OH-===H2O使平衡向脱矿方向移动
(2)5Ca2++3PO43-+F-===Ca5(PO4)3F↓
(3)加Ca2+或加PO43-等
12.(2010年潍坊质检)已知25 ℃时,电离常数Ka(HF)=3.6×10-4 mol/L,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液(忽略体积变化),则下列说法中,正确的是( )
A.25 ℃时,0.1 mol/L HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中,Ksp(CaF2)=
D.该体系中有CaF2沉淀产生
[解析] A项中由于HF为弱酸,故[H+]<0.1 mol/L,pH>1;B项中Ksp(CaF2)只与温度有关,与浓度无关;C项中Ksp(CaF2)与Ka(HF)不存在倒数关系,根据Ka(HF)=3.6×10-4得[H+]=[F-]==6×10-2mol/L
[Ca2+]==0.1 mol/L
Qc(CaF2)=0.1 mol/L×(6×10-2)2 mol2/L2≥Ksp(CaF2)=1.46×10-10
所以该体系中有CaF2沉淀产生,D对。
[答案] D
11.向Cr2(SO4)3溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根(CrO2-),其平衡关系如下:
 现向50 mL 0.05 mol·L-1的Cr2(SO4)3溶液中加入50 mL 1.0 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为( )
现向50 mL 0.05 mol·L-1的Cr2(SO4)3溶液中加入50 mL 1.0 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为( )
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
[解析] n(Cr3+)=0.05 L×0.05 mol·L-1×2=0.005 mol,n(OH-)=0.05 L×1.0 mol·L-1=0.05 mol,由题给信息知,Cr3+与OH-可能发生反应:①Cr3++3OH-===Cr(OH)3↓,②Cr3++4OH-===CrO2-+2H2O由于n(Cr3+)∶n(OH-)=0.005 mol∶0.05 mol=1∶10,所以应发生反应②,又由于反应后[OH-]==0.3 mol·L-1,pH≈13.5,故溶液为亮绿色。
[答案] C
10.为了除去ZnCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸,最好选的试剂是( )
A.NH3·H2O B.NaOH
C.ZnCO3 D.Na2CO3
[解析] A、B、D项在除去Fe3+的同时,分别引入新杂质:NH4+、Na+、Na+,而C项不会引入杂质。
[答案] C
9.将100 mL 0.1 mol/L的AgNO3溶液加入足量的NaCl和NaF的混合溶液中,产生1.435 g沉淀,则下列说法正确的是( )
A.产生的沉淀为AgCl
B.产生的沉淀为AgF
C.产生的沉淀为AgF和AgCl的混合物
D.溶度积:AgF小于AgCl
[解析] 由NaCl和NaF混合液足量可知,1.435 g沉淀只能是AgCl或AgF中更难溶的1种,由其物质的量为0.01 mol可知,应为AgCl,从而可知Ksp(AgF)>Ksp(AgCl)。
[答案] A
8.将氯化银加到溴化钠溶液中,白色不溶物变为淡黄色,把此淡黄色不溶物加到碘化钾溶液中,淡黄色不溶物变为黄色不溶物。此实验方案为了验证( )
A.活动性:Cl->Br->I-
B.还原性:I->Br->Cl-
C.稳定性:AgCl>AgBr>AgI
D.Ksp:AgCl>AgBr>AgI
[解析] 淡黄色不溶物为AgBr,黄色不溶物为AgI,说明沉淀从AgCl转化成AgBr,又转化成AgI,由溶解度相对大的转化成溶解度更小的沉淀可知,D项正确。
[答案] D
7.已知,同温度下的溶度积:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS。则以下离子方程式错误的是( )
A.FeS+2H+===Fe2++H2S↑
B.Cu2++H2S===CuS↓+2H+
C.Zn2++S2-+2H2O===Zn(OH)2↓+H2S↑
D.Mg2++2HCO3-+2Ca2++4OH-===2H2O+Mg(OH)2↓+2CaCO3↓
[解析] 反应的规律为易溶解或易电离的物质易转化为难溶解或难电离的物质,故A、B、D均符合此规律,C项中由于Zn(OH)2比ZnS溶解度大,所以Zn2+与S2-结合易发生复分解反应而不是双水解反应。
[答案] C
6.某温度下向饱和AgCl溶液中加水,下列叙述正确的是( )
A.AgCl的溶解度增大 B.AgCl的溶解度、Ksp均不变
C.AgCl的Ksp增大 D.AgCl的溶解度、Ksp均增大
[解析] 难溶物质的溶解度、溶度积常数都只与温度有关,温度不变,二者均不变。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com