
题目列表(包括答案和解析)
8.下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、[Al(OH)4]-、CO32-
C.在[H+]=10-13 mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
[解析] A项中Fe3+与SCN-反应;C项中[H+]=10-13 mol·L-1,则[OH-]==10-1 (mol·L-1),溶液呈碱性,NH4+与OH-反应;D项中H+、NO3-、Fe2+间发生氧化还原反应。
[答案] B
7.(2009年全国卷Ⅱ)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
[解析] 因为还原性Fe2+>Br-,在FeBr2溶液中通入Cl2时先发生反应:2Fe2++Cl2===2Fe3++2Cl-,通入过量Cl2时发生反应:2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-,所以当x≤0.5a时只发生前一个反应,当x≥1.5a时只发生后一个反应,当0.5a<x<1.5a时,Fe2+与Br-均参加反应,故选B。
[答案] B
6.(2010年海口质检)下列反应的离子方程式正确的是( )
A.锌片插入硝酸银溶液中:Zn+Ag+===Zn2++Ag
B.碳酸氢钙溶液加到醋酸中:
Ca(HCO3)2+2CH3COOH===Ca2++2CH3COO-+2CO2↑+2H2O
C.少量金属钠加到冷水中:
Na+2H2O===Na++OH-+H2↑
D.氢氧化铜加到盐酸中:
Cu(OH)2+2H+===Cu2++2H2O
[解析] A中电荷及得失电子均不守恒,正确的离子方程式为:Zn+2Ag+===Zn2++2Ag;B中Ca(HCO3)2为可溶性强电解质,应拆成离子形式,正确的离子方程式为:HCO3-+CH3COOH===CH3COO-+CO2↑+H2O;C中得失电子及原子均不守恒,正确的离子方程式为:2Na+2H2O===2Na++2OH-+H2↑。
[答案] D
5.下列A-D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是(多选)( )
|
|
(Ⅰ) |
(Ⅱ) |
|
A |
少量SO2通入Ba(OH)2溶液 |
过量SO2通入少量 |
|
Ba(OH)2溶液 |
|
|
|
B |
少量浓氨水滴入 |
|
|
Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
|
|
C |
0.1 mol Cl2通入含0.2 mol FeBr2的溶液 |
0.3 mol Cl2通入0.2 mol FeBr2溶液中 |
|
D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
[解析] A项离子方程式(Ⅰ)为SO2+2OH-===SO32-+H2O,(Ⅱ)为SO2+OH-===HSO3-;B项均可用Al3++3NH3·H2O===Al(OH)3↓+3NH4+表示;C项离子方程式(Ⅰ)为Cl2+2Fe2+===2Cl-+2Fe3+,(Ⅱ)为3Cl2+2Fe2++4Br-=== 6Cl-+2Fe3++2Br2;D项均可用Ba2++SO42-===BaSO4↓表示。
[答案] BD
4.能正确表示下列反应的离子方程式的是( )
A.小苏打溶液与醋酸反应:
HCO3-+H+===CO2↑+H2O
B.用铜作电极电解硫酸铜溶液:
2Cu2++2H2O 4H++2Cu+O2↑
C.饱和碳酸氢钙中加入过量的澄清石灰水:
Ca2++HCO3-+OH-===CaCO3↓+H2O
D.硫化亚铁与稀硝酸反应:
FeS+2H+===Fe2++H2S↑
[解析] A选项CH3COOH为弱酸,不能拆写成离子形式;B选项用铜电极电解CuSO4溶液,溶液组成不发生变化;D选项应该发生氧化还原反应。
[答案] C
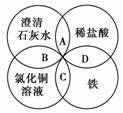
3.(2010年石狮质检)铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如右图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
A.OH-+HCl===H2O+Cl-
B.Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C.Fe+Cu2+===Cu+Fe2+
D.Fe+2H+===Fe3++H2↑
[解析] A项为盐酸与澄清石灰水反应的离子方程式,应为H++OH-===H2O;B项为澄清石灰水与CuCl2溶液的反应,应为2OH-+Cu2+===Cu(OH)2↓;C项为CuCl2溶液与Fe的反应;D项为Fe与盐酸的反应,应为Fe+2H+===Fe2++H2↑。
[答案] C
2.把0.05 mol NaOH固体分别加入到100 mL 下列液体中,溶液的导电能力变化最小的是( )
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1CH3COOH溶液
D.0.5 mol·L-1KCl溶液
[解析] 溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05 mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,溶液中不存在化学反应,但离子浓度增大一倍,导电能力增强;但盐酸中加入NaOH固体后,二者恰好中和:HCl+NaOH===NaCl+H2O,溶液中离子浓度不变,导电能力几乎不变。
[答案] B
1.下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
|
|
纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
A |
盐酸 |
水煤气 |
硫酸 |
醋酸 |
干冰 |
|
B |
氢氧化钡 |
蔗糖溶液 |
硫酸钡 |
醋酸 |
三氧化硫 |
|
C |
胆矾 |
石灰水 |
苛性钾 |
水 |
碳酸钙 |
|
D |
重钙 |
普钙 |
氯化钙 |
氢氧化铁 |
氢气 |
[解析] A项中盐酸属于混合物;C项中碳酸钙属于强电解质;D项中H2既不属于电解质又不属于非电解质。
[答案] B
16.已知在25 ℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似)。如:
AgX(s) Ag+(aq)+X-(aq)
Ag+(aq)+X-(aq)
Ksp(AgX)=[Ag+]·[X-]=1.8×10-10
AgY(s) Ag+(aq)+Y-(aq)
Ag+(aq)+Y-(aq)
Ksp(AgY)===[Ag+]·[Y-]=1.0×10-12
AgZ(s) Ag+(aq)+Z-(aq)
Ag+(aq)+Z-(aq)
Ksp(AgZ)=[Ag+]·[Z-]=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:________________________________________________________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则[Y-]________(填“增大”“减小”或“不变”)。
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为____________________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:______________________________。
②在上述(3)体系中,能否实现AgY向AgX的转化?根据你的观点选答一项。
若不能,请简述理由:________________________________________________________________________。
若能,则实现转化的必要条件是:_________________________________________
___________________________________。
[解析] (1)由于AgX、AgY、AgZ中阴阳离子个数比均为1∶1,故Ksp越大其溶解度越大,因此溶解度S(AgX)>S(AgY)>S(AgZ)。
(2)由于AgY比AgX更难溶,则向AgY的饱和溶液中加入AgX固体,发生沉淀的转化,AgX(s)+Y-(aq)===AgY(s)+X-(aq),则[Y-]减小。
(3)25 ℃时,AgY的Ksp=1.0×10-12,即溶液达到饱和时,[Ag+]=[Y-]=1.0×10-6 mol·L-1,而将0.188 g AgY溶于100 mL水中,形成的为饱和溶液(溶质还有未溶解的),则[Y-]=1.0×10-6mol·L-1。
(4)由于Ksp(AgZ)<Ksp(AgY),可以实现AgY向AgZ的转化。在(3)中,[Ag+]=1.0×10-6 mol·L-1,当[X-]>1.8×10-4 mol·L-1时,即可由AgY向AgX的转化。
[答案] (1)S(AgX)>S(AgY)>S(AgZ) (2)减小
(3)1.0×10-6 mol·L-1
(4)①能 Ksp(AgY)=1.0×10-12>Ksp(AgZ)=8.7×10-17
②能 当溶液中[X-]>1.8×10-4 mol·L-1时,AgY开始向AgX转化,若要实现AgY向AgX的完全转化,必须保持溶液中的[X-]>1.8×10-4 mol·L-1
15.已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s) mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=c(Mn+)m·c(Am-)n,称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25 ℃)
|
难溶电 解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-11 |
实验步骤如下:
①往100 mL 0.1 mol/L的CaCl2溶液中加入100 mL 0.1 mol/L的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④________________________________________________________________________。
(1)由题中信息Ksp越大,表示电解质的溶解度越______(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:_____________________________________________________________________。
设计第③步的目的是________________________________________________________________________。
请补充第④步操作及发生的现象:_________________________________________________________________________。
[解析] 本题考查的知识点为教材新增加的内容,题目在设计方式上为探究性实验,既注重基础知识、基本技能的考查,又注重了探究能力的考查。由Ksp表达式不难看出其与溶解度的关系,在硫酸钙的悬浊液中存在着:CaSO4(s)  SO42-(aq)+Ca2+(aq),而加入Na2CO3后,溶液中CO32-浓度较大,而CaCO3的Ksp较小,故CO32-与Ca2+结合生成沉淀,即CO32-+Ca2+===CaCO3↓。既然是探究性实验,必须验证所推测结果的正确性,故设计了③④步操作,即验证所得固体是否为碳酸钙。
SO42-(aq)+Ca2+(aq),而加入Na2CO3后,溶液中CO32-浓度较大,而CaCO3的Ksp较小,故CO32-与Ca2+结合生成沉淀,即CO32-+Ca2+===CaCO3↓。既然是探究性实验,必须验证所推测结果的正确性,故设计了③④步操作,即验证所得固体是否为碳酸钙。
[答案] (1)大
(2)Na2CO3+CaSO4===Na2SO4+CaCO3↓
洗去沉淀中附着的SO42-
向沉淀中加入足量的盐酸,沉淀完全溶解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com