
题目列表(包括答案和解析)
13.某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。




 + +
―→
+
+
+ +
―→
+
+
(2)反应中,被还原的元素是________,还原剂是________。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

 +
+……
+
+……
(4)纺织工业中常用氯气作漂白剂、Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为________。
[解析] (1)(2)(3)由2O3、2O、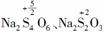 ,且Au2O3为反应物知,Au2O必为生成物,由在氧化还原反应中,元素化合价有降必有升知,Na2S2O3为反应物、Na2S4O6为生成物,由物料守恒得,H2O为反应物,NaOH为生成物。
,且Au2O3为反应物知,Au2O必为生成物,由在氧化还原反应中,元素化合价有降必有升知,Na2S2O3为反应物、Na2S4O6为生成物,由物料守恒得,H2O为反应物,NaOH为生成物。
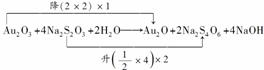
(4)由Na2S2O3+Cl2―→H2SO4+NaCl+HCl知,Cl2作氧化剂、Na2S2O3作还原剂。则1 mol Cl2反应得2 mol e-,1 mol Na2S2O3反应失8 mol e-,由得失电子守恒知,n(Na2S2O3)∶n(Cl2)=1∶4。
[答案] (1)Na2S2O3 H2O Na2S4O6 Au2O NaOH
(2) Na2S2O3
(3)
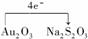 (4)1∶4
(4)1∶4
12.“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为:KCN+H2O2+H2O===A+NH3↑。回答下列问题:
(1)生成物A的化学式为__________。
(2)在标准状况下有0.448 L氨气生成,则转移的电子数为________。
(3)反应中被氧化的元素为________。
(4)H2O2被称为“绿色氧化剂”的理由是________________________________________________________________________
________________________________________________________________________。
[解析] (1)根据化学反应中元素守恒原则可知,A的化学式为KHCO3。
(2)H2O2中O的化合价为-1价,反应后变为-2价,每生成1 mol NH3,转移2 mol电子,标准状况下0.448 L NH3的物质的量为0.02 mol,则转移电子的物质的量为0.04 mol,转移的电子数为2.408×1022。
(3)反应中被氧化的元素为C,C元素的化合价由+2价变为+4价。
[答案] (1)KHCO3 (2)2.408×1022 (3)C(碳)
(4)H2O2作氧化剂,还原产物为H2O,没有毒性及污染
10.在3BrF3+5H2O===HBrO3+Br2+9HF+O2↑的反应中,每当有3 mol BrF3参加反应时,被水还原的BrF3的物质的量是( )
A.1 mol B. mol
C.2 mol D.3 mol
[解析] 在3BrF3+5H2O===HBrO3+Br2+9HF+O2↑反应中H2 ―→2,F3―→2,当有3 mol BrF3参加反应,H2O作还原剂,根据“电子守恒”得2 mol×(0+2)=n(3-0),n= mol。
[答案] B
9.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2―→H2O IO3-―→I2 MnO4-―→Mn2+ HNO2―→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO3-
C.MnO4- D.HNO2
[解析] KI被氧化得到I2,1 mol KI在反应中失去1 mol电子,凡能从I-夺取电子的物质均可作其氧化剂,该题实际是问,等物质的量的氧化剂在反应夺取电子多的便符合题意,据题中所给信息:
H2O2―→H2O 1 mol H2O2得2 mol e-,
IO3-―→I2 1 mol IO3-得5 mol e-,
MnO4-―→Mn2+ 1 mol MnO4-可得 5 mol e-,
HNO2―→NO 1 mol HNO2得1 mol e-。
虽然B、C选项中的IO3-、MnO4-均可得5 mol e-,但B中生成物I2可来自IO3-和I-,故得I2最多者应是IO3-与I-的反应。
[答案] B
8.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+===2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol ④M为OH- ⑤SnCl62-是氧化产物
A.①③⑤ B.①②④⑤
C.①②③④ D.①③
[解析] 方程式中Sn元素从+2价上升至+4价,SnCl2是还原剂,SnCl62-是氧化产物;As元素从+3价下降到0价,H3AsO3是氧化剂,As是还原产物。Cl元素化合价没发生变化,不能推出还原性:Cl->As,每生成7.5 g As,还原剂失去电子的物质的量为×3=0.3 mol。根据质量守恒和电荷守恒推知M应为H2O。综上所述②、④不正确,故选A。
[答案] A
7.(2010年佛山质检)对于反应CaH2+H2O===Ca(OH)2+2H2↑ ,有下列叙述:
①H2只是氧化产物 ②H2只是还原产物 ③水是氧化剂 ④Ca(OH)2是氧化产物 ⑤CaH2中的氢元素既被氧化、也被还原 ⑥此反应中的氧化产物和还原产物的物质的量之比是1∶1
其中正确的是( )
A.①④⑤ B.②④⑥
C.只有① D.③⑥
[解析] 反应中的电子转移情况为:
CaH2+2H2O===Ca(OH)2+2H失去2e-得到2e-2↑,
则反应中CaH2为还原剂,H2O为氧化剂,H2既是氧化产物,又是还原产物,且n(氧化产物)∶n(还原产物)=1∶1。
[答案] D
6.今有下列三个氧化还原反应:
2FeCl3+2KI===2FeCl2+2KCl+I2
2FeCl2+Cl2===2FeCl3
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中含有Fe2+和I-共存,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
[解析] 本题是寻找一种氧化剂,其氧化性应大于I2的氧化性,而小于Cl2和Fe3+的氧化性(也可等于Fe3+的氧化性)。由①知氧化性Fe3+>I2,还原性I->Fe2+;由②知氧化性Cl2>Fe3+,还原性Fe2+>Cl-;由③知氧化性MnO4->Cl2,还原性Cl->Mn2+;由此推知氧化性强弱顺序为:KMnO4>Cl2>FeCl3>I2,还原性强弱顺序为I->Fe2+>Cl->Mn2+。所以KMnO4可氧化Cl-、Fe2+及I-,Cl2可氧化Fe2+及I-,FeCl3只氧化I-。
[答案] C
5.(2010年杭州质检)下列物质:①浓H2SO4;②HNO3;③Cl2;④H2;⑤O2;⑥Ag;⑦HCl溶液;⑧KMnO4;⑨MnO2;⑩CO。其中属于常见的氧化剂的一组是( )
A.①②③④⑤⑧⑨ B.①②③⑤⑧⑨
C.①②③⑤⑥⑦⑧ D.①②③⑤⑦⑨⑩
[答案] B
4.下面有关氧化还原反应的叙述正确的是( )
A.在反应中不一定所有元素的化合价都发生变化
B.肯定有一种元素被氧化,另一种元素被还原
C.非金属单质在反应中只做氧化剂
D.某元素从化合态变为游离态时,该元素一定被还原
[解析] 在2H2S+SO2===3S↓+2H2O的反应中,被氧化的元素与被还原的元素均为S元素,故B项错误;在H2+Cl22HCl的反应中,H2做还原剂,C项错误;元素在化合态中若为正价,则元素被还原,相反,若元素在化合态中为负价,则被氧化,D项错误。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com