
题目列表(包括答案和解析)
3.下列叙述错误的是( )
A.烷烃的沸点随碳原子数增加而逐渐升高
B.任何烷烃分子中碳氢原子个数比都是相同的
C.丙烷与Cl2发生取代反应后生成的一卤代物不只是一种
D.正丁烷的熔点、沸点比异丁烷的高
[解析] 烷烃的沸点随着碳原子数增加而逐渐升高;烷烃的通式为CnH2n+2,烷烃分子中N(C)∶N(H)=n∶(2n+2);丙烷与Cl2发生取代是逐一分步进行,生成一卤代物有两种;烷烃支链越多,沸点越低。
[答案] B
2.下列物质①CO2,②CHCl3,③CH4,④CCl4,⑤P4其结构具有正四面体构型的是( )
A.①②③ B.③④⑤
C.②③④ D.①②③④⑤
[解析] CH4和CCl4是以C为中心的正四面体结构,P4是空心的四正面体,CHCl3分子中由于C周围的四个原子不完全相同,其分布不均匀,故不是正四面体。CO2是直线形分子。
[答案] B
1.已知天然气的主要成分甲烷是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述:①天然气与煤、石油相比是比较清洁的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一。其中正确的是( )
A.①②③ B.只有①
C.①和② D.只有③
[解析] 等质量的CH4和CO2,CH4的物质的量多,因等物质的量的CH4和CO2产生的温室效应前者大,所以等质量的CH4和CO2,CH4产生的温室效应更大。故答案为C。
[答案] C
16.某校化学实验活动小组通过实验来探究一包黑色粉末是氧化铜、氧化亚铁或二者的混合物,探究过程如下:
(1)提出假设
假设1,黑色粉末是FeO;
假设2,黑色粉末是____________(写化学式);
假设3,黑色粉末是____________(写化学式)。
(2)设计探究实验。
实验小组选用稀硫酸、氯水、硫氰化钾溶液做试剂进行实验,请将实验操作步骤及现象填入下表。
|
实验操作 |
实验现象 |
实验结论 |
|
取少量粉末加入足量稀硫酸 |
|
假设1成立 |
|
|
|
假设2成立 |
|
|
假设3成立 |
(注意:假设2、假设3的现象应与假设相对应)
(3)经过实验及分析,确定该黑色物质为氧化铜和氧化亚铁的混合物。实验小组欲利用该黑色粉末制取较纯净的硫酸铜,通过查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3。实验小组设计了如下实验方案:
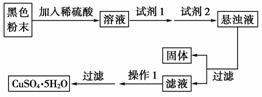
试回答:试剂1为__________,试剂2为__________(填字母),固体X的化学式是__________;操作1的名称为________。
[解析] 当黑色物质溶于稀H2SO4,且得到溶液显浅绿色,便可证明该黑色物质是FeO;当黑色粉末溶于稀H2SO4得蓝色溶液,再向其中滴入KSCN溶液,无明显变化,再加入Cl2水溶液若呈血红色可证明黑色物质是CuO和FeO混合物,若溶液仍呈蓝色,可证明黑色物质是CuO。
以CuO和FeO混合物为原料制CuSO4,首要任务是除去杂质。根据题设条件的路线,试剂1应为H2O2,以便将Fe2+氧化为Fe3+,并避免引入新杂质,然后用Cu2(OH)2CO3调pH,使Fe3+形成Fe(OH)3沉淀,过滤将滤液蒸发、浓缩、冷却结晶便可得到纯净的CuSO4·5H2O。
[答案] (1)CuO CuO和FeO
(2)
|
实验操作 |
实验现象 |
实验结论 |
|
|
黑色粉末完全溶解得浅绿色溶液 |
|
|
取少量粉末加足量稀H2SO4加几滴KSCN溶液再加几滴氯水 |
只得蓝色溶液 |
|
|
先形成蓝色溶液最后得血红色溶液 |
|
(3)B D Fe(OH)3 蒸发
15.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是______________________________________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是______________________________________________。
(3)③中所发生的各反应的离子方程式是______________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
[解析] (1)铝与某些金属氧化物发生置换反应时放出大量的热,常称作铝热反应。实验时常用氯酸钾,并在混合物中间插一条镁条,用小木条点燃镁条加以引燃。反应的化学方程式为2Al+Fe2O32Fe+Al2O3。
(2)在等物质的量的MgO和Fe2O3组成的混合物中加入盐酸,发生的反应是Fe2O3+6HCl===2FeCl3+3H2O;MgO+2HCl===MgCl2+H2O。
(3)将①中得到的单质Fe和溶液C(含HCl和FeCl3)反应,放出1.12 L(标准状况)气体,同时生成溶液D,发生反应的化学方程式为:Fe+2H+===Fe2++H2↑,Fe+2Fe3+===3Fe2+(Fe有残留)。
(4)n(MgO)=n(Fe2O3)==0.1 mol,
c(Mg2+)==0.67 mol·L-1,
由Fe + 2Fe3+ === 3Fe2+得n(Fe2+)=n(Fe3+)=×0.1 mol ×2=0.3 mol
由Fe + 2H+===Fe2+ + H2↑得n(Fe2+)=n(H2)==0.05 mol
n(Fe2+)=0.3 mol+0.05 mol=0.35 mol,
c(Fe2+)==2.3 mol·L-1。
[答案] (1)加少量KClO3,插上Mg条并将其点燃 Fe
(2)Fe2O3+6HCl===2FeCl3+3H2O,
MgO+2HCl===MgCl2+H2O
(3)Fe+2H+===Fe2++H2↑,Fe+2Fe3+===3Fe2+
(4)0.67 mol·L-1 2.3 mol·L-1
14.A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
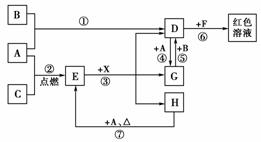
(1)写出化学式:
A________、D________、E________、X________。
(2)在反应①-⑦中,不属于氧化还原反应的是________(填编号)。
(3)反应⑥的离子方程式为________________________________________________________________________。
(4)反应⑦的化学方程式为________________________________________________________________________;
该反应中每消耗0.3 mol的A,可转移电子________mol。
(5)写出D的溶液与小苏打溶液、D的溶液中通入少量SO2反应的离子方程式:________________________________________________________________________。
[解析] 根据反应③及E为黑色固体,X为无氧强酸,D中含有Fe3+,推知E为Fe3O4、X为HBr、D为FeBr3,G为FeBr2、H为H2O,顺次推出反应⑦为3Fe+4H2O(g)Fe3O4+4H2;根据反应②及A为固体,C为气体,推知A为Fe、C为O2;根据反应①,推知B为Br2;根据反应⑥,推知F中含有SCN-。
[答案] (1)Fe FeBr3 Fe3O4 HBr
(2)③⑥
(3)Fe3++3SCN-===Fe(SCN)3
(4)3Fe+4H2O(g)Fe3O4+4H2 0.8
(5)Fe3++3HCO3-===Fe(OH)3↓+3CO2↑
2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
13.用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入______________________。
(2)除去蒸馏水中溶解的O2常采用____________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是什么?
________________________________________________________________________。
方法二:在如右图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
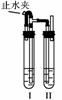
(1)在试管Ⅰ里加入的试剂是________________________________________________________________________。
(2)在试管Ⅱ里加入的试剂是____________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是什么?________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是什么?______________________________________________________________________________。
[解析] 方法一:(1)加入还原性铁粉是为了防止Fe2+被氧化;加入稀H2SO4的目的是抑制Fe2+的水解。
(2)加热煮沸是利用了气体的溶解度随着温度的升高而降低的规律。
方法二:主要用制取的H2将试管中的空气排净,然后让Fe2+与OH-接触,没有O2,Fe(OH)2当然能保存一段时间。
[答案] 方法一:(1)少量的铁粉和稀H2SO4
(2)加热煮沸
(3)防止NaOH吸收空气中的O2避免Fe(OH)2沉淀接触O2
方法二:(1)铁屑、稀H2SO4
(2)NaOH溶液
(3)检验试管后Ⅱ出口处排出的H2的纯度。当排出的H2纯净时,再夹紧止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ且外界空气不容易进入
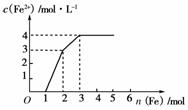
12.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
[解析] 据氧化性由强到弱的顺序HNO3>Fe3+>Cu2+,可知随铁粉的增加,反应的方程式分别为:
4HNO3+Fe===Fe(NO3)3+NO↑+2H2O
4 mol 1 mol 1 mol
2Fe(NO3)3+Fe===3Fe(NO3)2
2mol 1 mol 3 mol
Cu(NO3)2+Fe===Fe(NO3)2+Cu
1 mol 1 mol 1 mol
所以原溶液中,Fe(NO3)3、Cu(NO3)2、HNO3的物质的量之比为:(2 mol-1 mol)∶1 mol∶4 mol=1∶1∶4。
[答案] D
11.向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A.11.2 g B.5.6 g
C.2.8 g D.无法计算
[解析] 依题意,恰好反应后溶液中只存在FeCl2,根据元素守恒法,可建立关系n(Fe)=n(Fe2+)=n(Cl-)=n(HCl)=×0.1 L×1 mol·L-1=0.05 mol,m(Fe)=2.8 g。
解此题若用常规方法会非常烦琐,而用守恒法,从整体角度去思考,则非常简捷。质量守恒是化学的一个重要定律,在解题中经常用到。
[答案] C
10.在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水,以下叙述正确的是( )
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C.分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为3∶2∶3
D.明矾属硫酸盐,含结晶水,是混合物
[解析] A选项中铝热剂不单指Al粉和Fe2O3,还包括其他许多,如Al粉和V2O5、Al粉和MnO2等等,A错。
B选项中Fe2O3为不溶于水的物质,应加盐酸溶解后再加KSCN溶液,B错。
C.根据电子守恒,a mol Fe2O3变为Fe需6a mol电子,故H2、Al、CO的物质的量为3a、2a、3a,所以三者之比为3∶2∶3,故C对。
D.明矾为KAl(SO4)2·12H2O,是纯净物,D错。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com