
题目列表(包括答案和解析)
9.(2010年莆田质检)把锌片和铁片放在盛有稀食盐水和酚酞试液的表面皿中,如下图所示。最先观察到酚酞变红现象的区域是( )
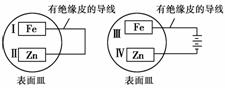
A.Ⅰ和Ⅲ B.Ⅰ和Ⅳ
C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
[解析] 酚酞变红,表明显碱性,判断哪一个电极上先生成OH-;左端装置属于原电池,Zn作负极,O2在Ⅰ上得电子生成OH-;右端装置是电解装置,Fe是阳极溶解,溶液中的H+在阴极Ⅳ-Zn上得电子析出H2,同时在溶液中生成OH-。所以Ⅰ和Ⅳ先变红。
[答案] B
8.
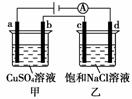
如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是( )
A.乙池中d的电极反应为:2Cl-―→Cl2+2e-
B.a、c两极产生气体的物质的量相等
C.甲、乙两池中溶液的pH均保持不变
D.乙池中发生的反应为:2NaCl+2H2O2NaOH+H2↑+Cl2↑
[解析] A项,d电极是阴极,应该是溶液中的阳离子放电,即2H++2e-―→H2↑,故不正确;B项,a、c均为阳极,甲池中是OH-放电产生O2,乙池中是Cl-放电产生Cl2,故产生气体的物质的量不相等,不正确;C项,甲池电解硫酸铜溶液,溶液的pH减小,乙池电解氯化钠溶液,溶液的pH增大,故不正确;D项正确。
[答案] D
7.用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是(多选)( )
A.AgNO3[AgNO3] B.NaOH[H2O]
C.KCl[KCl] D.CuSO4[CuO]
[解析] A选项4AgNO3+2H2O4Ag+O2↑+4HNO3,脱离反应体系的物质是4Ag+O2,相当于2Ag2O,所以应当加入适量的Ag2O才能复原(加入AgNO3,会使NO3-的量增加)。B选项2H2O2H2↑+O2↑,脱离反应体系的是2H2+O2,相当于2H2O,加入适量水可以复原。C选项2KCl+2H2O2KOH+H2↑+Cl2↑,脱离反应体系的是H2+Cl2,相当于2HCl,应通入适量HCl气体才能复原。D选项2CuSO4+2H2O2H2SO4+2Cu+O2↑,脱离反应体系的是2Cu+O2,相当于2CuO,加入适量CuO可以复原。
[答案] BD
6.下列装置的线路接通后,经过一段时间,溶液的pH明显下降的是( )

[解析] 对几个装置进行分析:A属于在铁上镀铜,溶液的浓度、pH不变;B铜作阳极溶解,变成Cu2+落入溶液,随即消耗2个OH-生成Cu(OH)2,阴极上H+得电子,生成2个OH-,NaOH浓度有所上升(水减少),但pH变化不大;C是电解饱和食盐水,生成NaOH,pH增大比较明显;而D则生成H2SO4,pH明显下降。
[答案] D
5.(2010年芜湖质检)如下图所示,x、y分别是直流电源的两极,通电后发现a极极板质量增加,b极极板处有无色无味的气体放出,符合这一情况的是( )
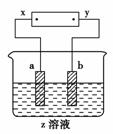
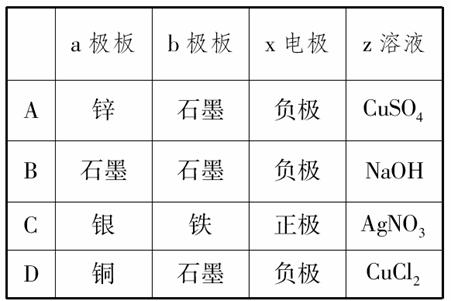
[解析] 由题意知a极板质量增加,a应为阴极,则b为阳极,x为电源的负极,y为电源正极。A选项中a极板为阴极,b极板为阳极,参考各个选项知,A项符合,电解时,a极有Cu附着,b极有O2放出;B项不符合,电解时a极无质量变化;C项阳极为Fe,为活性电极,电解时Fe在阳极放电溶解,无气体生成,故C项不符合;D项电解时,Cl-在阳极放电生成Cl2,Cl2为黄绿色有刺激气味的气体,与原题题意不符合。
[答案] A
4.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
[解析] 电解稀H2SO4,实质上是电解水,硫酸的物质的量不变,但溶液体积减少,浓度增大,故溶液pH减小。电解稀NaOH溶液,阳极消耗OH-,阴极消耗H+,实质也是电解水,NaOH溶液浓度增大,故溶液的pH增大。电解Na2SO4溶液时,在阳极发生反应:4OH-―→2H2O+O2↑+4e-,在阴极发生反应:2H++2e-―→H2↑,由于两电极通过电量相等,故放出H2与O2的物质的量之比为2∶1。电解CuCl2溶液时,阴极反应为Cu2++2e-―→Cu,阳极反应为2Cl-―→Cl2↑+2e-,两极通过电量相等时,Cu和Cl2的物质的量之比为1∶1。
[答案] D
3.某电解池内盛有CuSO4溶液,插入两根电极,接通直流电源后,欲达到如下要求:①阳极质量不变;②阴极质量增加;③电解液pH减小,则应选用的电极是(多选)( )
A.阴阳两极都是石墨 B.铜作阳极,铁作阴极
C.铁作阳极,铜作阴极 D.铂作阳极,铜作阴极
[解析] 不管用何材料作阴极都不影响电解结果,阴极只是完成导电作用便可。电解时生成H2SO4,pH自然会减小。要保持阳极质量不变,需要用惰性材料作电极:石墨或铂。
[答案] AD
2.(2010年温州质检)
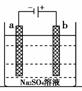
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
[解析] 电解Na2SO4溶液其实质是电解水,a与电源负极相连为电解池的阴极,H2O电离产生的H+在该极获得电子产生H2,同时生成OH-:2H2O+2e-―→H2↑+2OH-,产生的OH-与石蕊作用呈蓝色。b与电源正极相连为电解池的阳极,H2O电离产生的OH-在该极失去电子产生O2,同时生成H+:H2O―→O2↑+2H++2e-,产生的H+与石蕊作用呈红色。
[答案] D
1.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
[解析] B、C、D中的描述都是正确的。而电解熔融的氧化铝制取金属铝,是用石墨作阳极。
[答案] A
1.32 g+1.76 g 0.84 g =0.07 mol
n(C)∶n(H)=0.07 mol∶0.28 mol=1∶4,
故A的最简式为CH4。
(3)因最简式中H的含量已达最大,故CH4即为其分子式。
[答案] (1)甲能够求出
(2)CH4
(3)不需要;因其最简式中H的含量已达最大值,所以CH4即为A的分子式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com