
题目列表(包括答案和解析)
1.下列有关金属腐蚀与防护的说法正确的是(多选)( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
[解析] 纯银器表面在空气中易形成硫化银而使银器表面变黑,所以是化学腐蚀,A正确;铁与锡构成原电池,铁作负极,加快了铁的腐蚀,B错;海轮外壳中的金属与连接的锌块构成原电池,锌作负极,可以保护海轮,C正确;外加直流电源保护器件时,必须连接电源负极,D错。
[答案] AC
16.(2009年全国卷Ⅰ)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
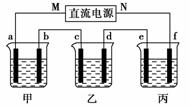
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为________________________________________________________________________;
③列式计算电极b上生成的气体在标准状况下的体积:
________________________________________________________________________
________________________________________________________________________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液________________________________________________________________________;
乙溶液________________________________________________________________________;
丙溶液________________________________________________________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?______________________________________________。
[解析] (1)①乙中c电极质量增加,说明c处发生的反应为:Cu2++2e-―→Cu,c电极应为阴极,则M为负极,N为正极。②甲中放的是NaOH溶液,电解时实质上是电解水,b电极上发生的电极反应为:4OH-―→2H2O+O2↑+4e-。而要求算出b电极上产生的气体体积,就必须先根据丙中K2SO4浓度的变化计算出转移电子的数目。
设丙中电解水的质量为x g,由电解前后溶质质量相等可得:100×10%=(100-x)×10.47%,x=4.5 g,所以整个反应转移了0.5 mol电子,根据电极方程式可计算出b电极放出的O2为0.125 mol,其体积为2.8 L,c电极上析出的铜为0.25 mol,其质量为16 g。
⑤甲中电解的是水,NaOH浓度增大;乙中水电离出来的OH-放电,H+浓度增大;丙中电解的也是水,虽然K2SO4浓度变大,但pH不变。
(2)铜全部析出时溶液变为H2SO4溶液,电解仍可以进行。
[答案] (1)①正 ②4OH-―→2H2O+O2↑+4e-
③水减少的质量:100 g×=4.5 g
生成O2体积:××22.4 L·mol-1=2.8 L
④16
⑤碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大 酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
0.004 mol 0.128 g,得M=64
[答案] (1)正 氧化 (2)阳 氧气 阴 氢气
(3)4OH-―→O2↑+2H2O+4e- (4)氧溶解
(5)不变 (6)64 g/mol
15.如下图所示,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:
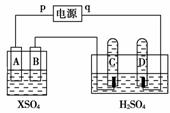
(1)p为____极,A极发生了________反应。
(2)C为______极,试管里收集到________;D为______极,试管里收集到________。
(3)C极的电极方程式是______________________________。
(4)在电解过程中,测得了C、D两极上产生的气体的实验数据如下:
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
阴极生成气体体积(cm3) |
6 |
12 |
20 |
29 |
39 |
|
阳极生成气体体积(cm3) |
2 |
4 |
7 |
11 |
16 |
|
时间(min) |
6 |
7 |
8 |
9 |
10 |
|
阴极生成气体体积(cm3) |
49 |
59 |
69 |
79 |
89 |
|
阳极生成气体体积(cm3) |
21 |
26 |
31 |
36 |
41 |
仔细分析以上实验数据,请说出可能的原因是____________。
(5)当反应进行一段时间后,A、B电极附近溶液的pH______(填“增大”“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为________。
[解析] (1)接通电源,X沉积于B极,说明B为阴极,则A为阳极,故(1)中q为负极,p为正极,A上发生氧化反应。(2)H2SO4电解池中,C为阳极,C试管内得O2,D为阴极,此试管内得H2。
(4)C、D两极所得O2、H2体积应该为1∶2,但实验数据由1∶3随时间变化而增大,到达10分钟时约为1∶2,因为开始O2溶解的原因。
(5)A极:X―→X2++2e-。B极:X2++2e-―→X,两极附近pH不变。
(6)设X的摩尔质量为M g/mol,则
X2++2e-―→X
2 mol M g
14.(1)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)===CuSO4+H2↑。请在下边方框内画出能够实现这一反应的实验装置图。
(2)某同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒却没有被腐蚀。请你分析其原因
____________________________;此时的电池反应为________________________________________________________________________
。
[解析] (1)由于铜的活泼性弱于氢,故通常条件下反应Cu+H2SO4(稀)===CuSO4+H2↑不能发生,但若设计成电解池,Cu作阳极,碳棒作阴极,则可实现上述反应。
(2)若将上述装置的电源接反,亦即碳棒为阳极,铜棒作阴极,则实际为电解水,两极均有气泡产生。
[答案] (1)
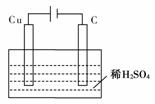
(2)将上述装置中的电源接反
铜棒(阴极):4H++4e-―→2H2↑
碳棒(阳极):4OH-―→2H2O+O2↑+4e-
0.02 mol×64 g/mol=1.28 g。
[答案] (1)不变 (2)Zn―→Zn2++2e- (3)1.28 Cu2++2e-―→Cu
13.在50 mL 2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中浓度将怎样变化__________________。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是____________________。
(3)如果不考虑H+在阴极上放电,当电路中有0.04 mol电子通过时,阴极增重________g,阴极上的电极反应式是__________________。
[解析] (1)、(2)类似于电镀原理。(3)由Cu2++2e-―→Cu可知:2 mol e--1 mol Cu,故阴极析出Cu:
12.实验室用铅蓄电池作电源电解AgNO3溶液,电池两极发生如下反应:正极:PbO2+4H++SO42-+2e-―→PbSO4+2H2O,负极:Pb+SO42-―→PbSO4+2e-,当电解析出2.16 g Ag单质时,电池内消耗H2SO4的物质的量是( )
A.0.01 mol B.0.02 mol
C.0.03 mol D.0.04 mol
[解析] 首先确定析出Ag与转移电子数的关系,其次抓住电解进行时,电池两极上转移的电子与电解池两极上得失的电子数是相等的。析出Ag:=0.02 mol。由Ag++e-―→Ag得电解池中两极上转移的电子数为0.02 mol。蓄电池的总反应(两电极反应式相加):
Pb+Pb2e-O2+2H2SO42PbSO4+2H2O。每转移2 mol电子消耗2 mol H2SO4,现转移0.02 mol电子,消耗0.02 mol H2SO4。
[答案] B
11.(2010年莱芜质检)某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1,用石墨做电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是( )
A.阴极自始至终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
[解析] 由题意知:n(H+)∶n(Cl-)=2∶3,在阴极放电的是H+,在阳极放电的是Cl-,Cl-放电完后是OH-。因此反应开始在两极放电的是H+、Cl-,相当于电解盐酸。由H2SO4电离的H+放电完后,在两极放电的是由水电离的H+和剩余的Cl-,相当于电解NaCl的水溶液。Cl-放电完后,在两极放电的是由水电离的H+和OH-,相当于电解水。故A、B、C是正确的。溶液pH的变化是不断增大,但最后溶质是NaOH和Na2SO4,pH不会为7。
[答案] D
10.(2009年浙江高考)市场上经常见到的标记为Liion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO2放电充电2Li0.85NiO2
下列说法不正确的是( )
A.放电时,负极的电极反应式:Li―→Li++e-
B.充电时,Li0.85NiO2 既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
[解析] 本题考查考生对原电池和电解池相关知识的理解,同时也考查考生的信息处理能力,对氧化还原反应相关知识的理解与应用。根据题目所给电池反应,放电时,其负极为Li,反应为Li―→Li++e-;充电时,实质上是电解Li0.85NiO2,故反应的氧化剂和还原剂均为Li0.85NiO2;由于Li具有很强的还原性,能与H2O反应,所以,不能用水溶液作为电解质;电池在放电时,负极有Li+生成,Li+将向正极移动。答案为D。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com