
题目列表(包括答案和解析)
4.如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是( )

A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
[解析] 铁铜组成原电池铁作负极,铁铝组成原电池铁作正极。a中铁被氧化,正极铜丝周围氧气得电子发生还原反应,生成氢氧根离子使酚酞变红,b中铁钉上氧气得电子发生还原反应,生成氢氧根离子使酚酞变红,铝条失电子变为铝离子无气泡产生。
[答案] B
3.下列变化中,属于原电池反应的是( )
①在空气中金属铝表面迅速氧化形成保护层 ②白铁(镀锌)表面有划损时,也能阻止铁被氧化 ③红热的铁丝与水接触表面形成蓝黑色的保护层 ④铁与稀硫酸反应时,加入少量CuSO4溶液,可使反应加快
A.①② B.②③
C.③④ D.②④
[解析] ①金属铝表面迅速氧化形成致密的氧化物Al2O3薄膜,保护铝不再被腐蚀,不属于原电池反应;③3Fe+4H2O(g)高温,Fe3O4+4H2,Fe3O4为蓝黑色的保护膜,不属于原电池反应;②Zn较Fe活泼,一旦遇到电解质溶液时,Zn活泼失电子,保护铁,构成了原电池;④中发生反应Fe+CuSO4===FeSO4+Cu,构成Fe-稀H2SO4-Cu原电池,加快反应。
[答案] D
2.下列说法正确的是( )
A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.25 ℃、101 kPa,1 mol S和2 mol S的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
[解析] 中和热是在稀溶液里强酸与强碱发生中和反应生成1 mol水时所释放出的热量,而1 mol H2SO4和1 mol Ba(OH)2完全中和时生成2 mol H2O,A错误;燃烧热指在25 ℃、101 kPa时1 mol该物质完全燃烧生成稳定的氧化物,所放出的热量,与实际燃烧的硫的物质的量无关,B正确;C不完全燃烧产生的CO是一种良好的气体燃料,其燃烧反应一定是放热反应,C错误;燃烧热是温度和压强的函数,因为不同温度下测得的反应热是不同的,故未指明温度谈燃烧热无意义,且若碳不完全燃烧所放出的热量也不能称为燃烧热,D错误。
[答案] B
1.下列说法不正确的是( )
①在热化学方程式中无论是反应物还是生成物都必须标明状态②所有的化学反应都伴随着能量变化 ③放热反应发生时不必加热 ④吸热反应在加热后才能发生 ⑤化学反应的热效应数值只与参加反应的物质的多少有关 ⑥一般来说,吸热反应在一定条件下也能发生 ⑦依据盖斯定律,反应焓变的大小与反应的途径有关,无论是一步完成还是分几步完成,其总的热效应完全相同
A.②③⑥⑦ B.③④⑤⑦
C.④⑤⑦ D.③④⑦
[解析] 放热反应有时需要加热才能实现,如燃烧反应,③错误;有些吸热反应不需要加热就能发生,如铵盐与Ba(OH)2混合研磨就能反应,④错误;化学反应的热效应不仅与反应物的多少有关,还与物质的状态有关,⑤错误;从盖斯定律来看,反应焓变的大小与途径无关,故⑦错误。
[答案] B
0.20 mol×2×6.02×1023 mol-1×1.6×10-19 C=3.85×104 C
16.(2010年石狮质检)(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:________________________________________________________________________;
银片上发生的电极反应:________________________________________________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电荷为1.60×10-19 C)
[解析] (1)锌-银在稀硫酸中组成原电池,锌比银活泼,锌失去电子作负极,电极反应为Zn―→Zn2++2e-,银作正极,电极反应为2H++2e-―→H2↑。
(2)Zn+2H+===Zn2++H2↑,减少的质量就是参加反应锌的质量,故参加反应的锌为60 g-47 g=13 g,用锌来计算生成氢气的体积。通过计算消耗锌转移电子的物质的量,进一步计算通过的电量。
[答案] (1)Zn―→Zn2++2e- 2H++2e-―→H2↑
(2)①锌片与银片减少的质量等于生成氢气所消耗的锌的质量,设产生的氢气体积为x,m(Zn)=60 g-47 g=13 g。
Zn+2H+===Zn2++H2↑
65 g 22.4 L
13 g x
x=13 g×22.4 L÷65 g=4.48 L
②反应消耗的锌为:13 g÷65 g·mol-1=0.20 mol
1 mol Zn变为Zn2+时,转移2 mol e-,则通过的电量为:
15.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1NaOH溶液中,如图所示:

请回答:
(1)写出甲池中正极的电极反应式:____________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式。负极:____________________________;总反应的离子方程式:____________________________。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强。(填写元素符号)
(4)由此实验,可得到如下哪些正确结论?________(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动顺序表已过时,已没有应用价值
d.该实验说明化学研究对象复杂,反应受条件的影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断电池中的正负极”的这种说法________(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案________________________________________________________________________
________________________________________________________________________。(如可靠,此空可不填)
[解析] (1)甲中电解质溶液为稀H2SO4溶液,由于金属活泼性Mg>Al,故负极为Mg,正极为Al,正极的电极反应式:2H++2e-===H2↑。(2)乙中电解质溶液为NaOH溶液,该溶液不能与Mg反应,故Mg作正极,Al作负极,负极的电极反应式:Al+4OH-―→[Al(OH)4]-+3e-,总反应的离子方程式为:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑。(3)一般情况下,构成原电池的两极(都是金属),负极比正极活泼,所以甲会判断出Mg的活动性更强,这是正确的,乙会判断出Al的更强,这是错误的。(4)两种相同的金属在电解质溶液不同时,得出两种不同的结果,说明反应条件对反应结果的影响较大,故应选a、d。(5)很明显,这种方法不可靠;可以在两极之间连一个电流计,测电流的方向,根据电流由正极流向负极来判断。
如图所示

[答案] (1)2H++2e-―→H2↑
(2)Al+4OH-―→[Al(OH)4]-+3e- 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
(3)Mg Al (4)ad
(5)不可靠 在两电极之间连上一个电流计,测电流的方向,根据“电流由正极流向负极”来判断
14.称取三份锌,分盛三支试管,在试管甲里加入pH=3的盐酸50 mL,在试管乙里加入pH=3的醋酸50 mL,在试管丙里加入pH=3的醋酸50 mL及少量铜粉,塞上导管塞子,定时测定生成H2的体积。若反应终了时,生成H2一样多,且锌没有剩余。
(1)用“>”、“=”或“<”回答以下问题:
①参加反应的锌的质量关系:______________。
②反应完毕,需反应时间的多少:________________________________________________________________________。
(2)简答:①反应所需时间最长的一种酸的原因是:________________________________________________________________________
________________________________________________________________________。
②乙、丙反应所需时间是否相等?________。其原因是:____
________________________________________________________________________。
[答案] (1)①甲=乙=丙 ②甲>乙>丙
(2)①随着反应的进行,盐酸里c(H+)减小得最多,反应速率减小最快,时间最长 ②不相等 丙中形成了铜锌原电池,加速了锌的反应,丙中反应较乙中快
13.将AsO43-+2I-+2H+AsO33-+I2+H2O设计成如下图所示的电化学装置,其中C1、C2均为碳棒。甲、乙两组同学分别进行下述操作:
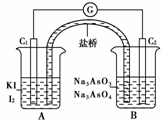
甲组:向B烧杯中逐滴加入浓盐酸
乙组:向B烧杯中逐滴加入40%NaOH溶液
请回答:
(1)甲组操作装置为________,乙组操作装置为________。
(2)两次操作过程中,微安表(G)的指针偏转方向相反,原因是
________________________________________________________________________
________________________________________________________________________。
(3)甲组操作过程中,C2作______极,电极反应式为________________________________,乙组操作过程中,C1作________极,电极反应式为________________。
[解析] (1)由于该电化学装置无外接电源,所以二者均为原电池。(2)题目所给反应原理是一个可逆反应,加入浓盐酸c(H+)增大,有利于反应向右进行,加入NaOH溶液,c(H+)减小,有利于反应向左进行,则两个过程电子流向正好相反,则电流流向相反,电流计指针偏转方向不同。
[答案] (1)原电池 原电池
(2)加入浓盐酸,总反应向右进行,加入NaOH溶液总反应向左进行,电子流动方向相反,所以指针偏转方向相反
(3)正 AsO43-+2e-+2H+―→AsO33-+H2O
正 I2+2e-―→2I-
12.(2010年蚌埠质检)铜板上铁柳钉处的吸氧腐蚀原理如右图所示,下列有关说法中,不正确的是( )
A.正极电极反应式为2H++2e-―→H2↑
B.此过种中还涉及到反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
[解析] 铁柳钉在与铜板接触处发生吸氧腐蚀,Fe活泼性强,故Fe失电子被腐蚀,Fe作负极;正极上应为O2得电子,发生的反应为O2+2H2O+4e-―→4OH-,总式为2Fe+O2+2H2O===2Fe(OH)2,Fe(OH)2在空气中继续被氧化为Fe(OH)3,发生的反应为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com