
题目列表(包括答案和解析)
7.(2010年临海质检)已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸和稀NaOH溶液反应生成1 mol水,放出57.3 kJ的热量
[解析] 燃烧热是1 mol可燃物完全燃烧生成稳定化合物时所放出的热量,因此表示燃烧热只标出数值和单位,即不再标出符号来表示放热。中和热是在稀溶液中酸跟碱发生中和反应生成1 mol H2O时放出的热量。对于强酸、强碱的稀溶液发生中和反应生成1 mol H2O中和热为57.3 kJ/mol。由中和热定义知中和反应也是放出热量,故中和热也只表示数值和单位即可,不再标出表示放热的“-”号,故C错误。由于2C(s)+O2(g)===2CO(g)燃烧生成的是CO,不是稳定的氧化物,因此=110.5 kJ/mol不是碳的燃烧热。由于不稳定的CO转化为稳定CO2又放出热量,故碳的燃烧热大于110.5kJ/mol。反应热的表示包含三部分“符号”“数值”和“单位”表示放热还是吸热。而B选项中没有表示出符号故错误;由于稀醋酸是弱电解质电离时吸收热量,故稀醋酸与稀NaOH溶液反应生成1 mol H2O,放出的热量小于57.3 kJ。
[答案] A
6.(2010年扬州质检)下列各组变化中,化学反应的反应热前者小于后者的一组是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1;
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)===2H2O(l) ΔH1;
H2(g)+O2(g)===H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)===CaO(s)+CO2(g) ΔH1;
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A.①②③ B.②④
C.②③④ D.③④
[解析] ①中 ΔH1和ΔH2均小于零,由于H2O(l)===H2O(g)吸收能量,故|ΔH1|>|ΔH2|,因此ΔH1<ΔH2。②中ΔH1=2ΔH2,又ΔH1、ΔH2均小于零,所以ΔH1<ΔH2。③中在恒压容器建立平衡后SO2的转化率大于恒容容器中SO2的转化率,故Q1<Q2。④中ΔH1>0,ΔH2<0,所以ΔH1>ΔH2。
[答案] A
5.丙烷是液化石油气的主要成分,其燃烧热为2 217.8 kJ/mol,表示丙烷燃烧热的热化学方程式为( )
A.C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) ΔH=+2 217.8kJ/mol
B.C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) ΔH=-2 217.8kJ/mol
C.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 217.8 kJ/mol
D.C3H8(g)+O2(g)===CO2(g)+H2O(l) ΔH=-443.6 kJ/mol
[解析] A项有两处错误:①H2O应为液态;②ΔH<0;B项中H2O应为液态;D项中C3H8物质的量应为1 mol。
[答案] C
4.已知热化学方程式2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ/mol,则关于热化学方程式2H2O(l)===2H2(g)+O2(g) ΔH2=?的说法正确的是( )
A.热化学方程式中化学计量数表示分子数
B.该反应ΔH2大于零
C.该反应ΔH2=-571.6 kJ/mol
D.该反应与上述反应属于可逆反应
[解析] 热化学方程式中的化学计量数表示物质的量,而不表示分子数。该反应是2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ/mol,逆向进行的反应,反应热为ΔH2=+571.6kJ/mol,但该反应不属于上述反应的可逆反应,因反应条件不相同。
[答案] B
3.已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+O2(g) ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+O2(g)===H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
[解析] 据题意及热化学方程式的书写规则,可知热化学方程式为:
H2(g)+O2(g)===H2O(g) ΔH=-242 kJ·mol-1
或2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
也可将H2O(g)写作反应物,H2(g)、O2(g)写作生成物,但此时ΔH的符号为“+”,即A符合题意。
[答案] A
2.已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
[解析] X+Y===M+N ΔH>0,就说明X与Y的总能量低于M、N的总能量,A错,D正确;破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,C错;吸热反应有的不需要加热也可反应,如氢氧化钡晶体与氯化铵搅拌即可。
[答案] D
1.(2010年泰安质检)

能源分类相关图如图所示,下面四组能源中,全部符合图中阴影部分的能源是( )
A.煤炭、石油、沼气
B.水能、生物能、天然气
C.太阳能、风能、潮汐能
D.地热能、海洋能、核能
[解析] 由所给图示可知,阴影部分所表示的为太阳能、可再生能源和新能源的交集。A中煤炭、石油均属于化石能源,属不可再生能源,A错误;B中天然气属不可再生能源,B错误;C中三者都既是新能源,又是可再生能源,且风能、潮汐能都是来自于太阳辐射的能量,C正确;D中核能不属于可再生能源,D错误。
[答案] C
17.(12分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如下图所示。
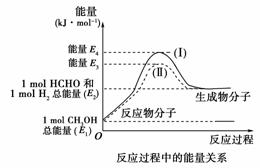
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应。
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? 原因是________________________________________________________________________
________________________________________________________________________
。
(3)写出甲醇催化脱氢转化为甲醛的热化学反应方程式
________________________________________________________________________。
(4)甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700 ℃,需向体系中通入空气,则进料甲醇与空气的物质的量理论比值为________[假设:H2(g)+O2(g)===H2O(g) ΔH=-a kJ·mol-1,空气中氧气体积分数为0.2]。
[答案] (1)吸热 (2)相同 一个化学反应的反应热仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关
(3)CH3OH(g)HCHO(g)+H2(g)
ΔH=(E2-E1)kJ·mol-1
(4)
16.(10分)(2010年潍坊质检)如图甲、乙是电化学实验装置。
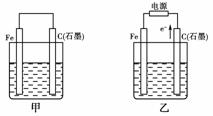
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为______________________;
②乙中总反应的离子方程式为______________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为__________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入____________________(填写物质的化学式)________g。
[解析] (1)若两烧杯中均盛有NaCl溶液,则:①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-―→4OH-。②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为2Cl-+2H2OCl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe―→Fe2++2e-。②乙装置为电解池,电解反应为:2CuSO4+2H2O2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+-CuO-CuCO3,电解后n(H+)=0.1×0.2=0.02(mol),故m(CuO)=0.02××80=0.8(g),m(CuCO3)=0.02××124=1.24(g)。
[答案] (1)①O2+2H2O+4e-―→4OH-
②2Cl-+2H2O2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O===10HCl+2HIO3
(2)①Fe―→Fe2++2e- ②CuO(或CuCO3) 0.8(或1.24)
15.(10分)(2010年安庆质检)某课外活动小组准备用如图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
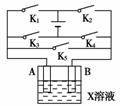
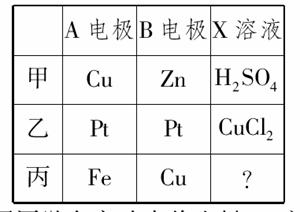
(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为________________________________________________________________________。
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为________________________________________________________________________;
实验时应闭合的电键组合是 。(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2 B.K1和K3
C.K1和K4 D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐的化学式为____________,实验时,应闭合的电键组合是________(选项如上)。
[解析] (1)闭合K5后构成原电池,Zn为负极。
(2)将电源与题给装置构成闭合回路即可。
(3)电镀时,选择含镀层金属离子的溶液为电镀液,Fe应连接电源的负极,Cu连接电源的正极。
[答案] (1)Zn―→Zn2++2e-
(2)CuCl2Cu+Cl2↑ C、D
(3)CuCl2或CuSO4 D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com