
题目列表(包括答案和解析)
6.如右图所示,某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
( )

A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
[解析] 这是一个按照电解饱和食盐水原理设计的趣味实验,根据原理可知电极反应式为
阴极:2H2O+2e-===H2↑+2OH-(发生还原反应)
阳极:2Cl--2e-===Cl2↑(发生氧化反应)
若要能够出现“黑笔写红字”的现象,必须是铅笔作阴极,这样铅笔附近产生的OH-会使酚酞变红。因此与铅笔相连的a点是直流电源的负极。
[答案] D
5.(2008年江苏)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O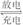
 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是
( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
[解析] 本题主要考查原电池的相关知识。电池的充、放电互为相反的过程。充电时作为电解装置,电能转化为化学能,阳极发生氧化反应,电极反应为:Ni(OH)2-e-+OH-===NiOOH+H2O,A正确,B错误。放电时作为原电池装置,化学能转变为电能,负极镉失去电子发生氧化反应,变为Cd2+,吸收OH-,负极周围碱性增强,所以C、D错误。
[答案] A
4. 某同学按下图所示的装置进行电解实验。下列说法正确的是
某同学按下图所示的装置进行电解实验。下列说法正确的是
( )
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
[解析] Cu作阳极被消耗、溶液中H+放电在阴极析出。因此,电解后一段时间c(H+)减小,当生成的CuSO4浓度不断增大后,Cu2+在阴极放电而析出。
[答案] BC
3.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
( )
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-===Cl2↑
D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子
[解析] 两极的反应为阴极:2H++2e-===H2↑;阳极:2Cl--2e-===Cl2↑,Cl2+2Ni2++6OH-===Ni2O3+2Cl-+3H2O,A项铁为活性电极,参与反应,Cl-不能放电,不能生成Cl2;B项阳极OH-被消耗,pH下降。
[答案] CD
2.(2008年海南)关于铅蓄电池的说法正确的是
( )
A.在放电时,正极发生的反应是Pb(s)+SO(aq)-2e-===PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-===Pb(s)+SO(aq)
[解析] A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO+2e-===PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生氧化反应。
[答案] B
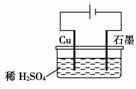
1.(2008年上海)取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直接电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是
( )
A.b电极是阴极
B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
[解析] 根据题意,a电极应产生Cl2,为阳极,与电源正极相连,则b为阴极。D项中b电极上H+放电,附近OH-浓度增大,pH变大。
[答案] D
14.(2009年天津理综)氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池的能量转化主要形式是
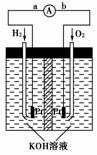
________________________________________________________________________,
在导线中电子流动方向为__________________________(用a、b表示)。
(2)负极反应式为___________________________________________________________。
(3)电极表面镀铂粉的原因为_______________________________________________
________________________________________________________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H22LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是__________,反应Ⅱ中的氧化剂是____________。
②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为______mol。
[解析] (1)电池即是把化学能转变为电能的装置;在电池中电子是从负极经导线流向正极,而氢氧燃料电池中通入H2的一极是负极,故电子由a流动到b。(2)H2在负极失电子,因为电解质溶液是KOH溶液,故负极反应式为2H2+4OH--4e-===4H2O。(3)电极表面镀铂粉可以增大电极单位面积吸附H2、O2的分子数,从而增大反应速率。(4)LiH中Li为+1价,H为-1价故反应Ⅰ中还原剂是Li,反应Ⅱ中氧化剂是H2O。由反应Ⅰ可知吸收标准状况下224 L H2时生成160 g LiH,则生成的LiH的体积是,则生成的LiH体积与被吸收的H2的体积比为:=。由②生成的20 mol LiH与H2O反应,由反应Ⅱ可知生成20 mol H2,H2-2e-,能量转化率为80%,则通过电子的物质的量为20 mol×2×80%=32 mol。
[答案] (1)由化学能转变为电能 由a到b
(2)2H2+4OH--4e-===4H2O或H2+2OH--2e-===2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
(4)①Li H2O ②1/1 148或8.71×10-4 ③32
13.(2009年海南单科)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为______________,发生的电极反应为________________;
(2)电池正极发生的电极反应为_______________________________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是__________________________________,反应的化学方程式为______________________________________;
(4)组装该电池必须在无水、无氧的条件下进行,原因是________________________
________________________________________________________________________。
[解析] (1)、(2)电池负极发生氧化反应,正极发生还原反应。(3)由NaOH与SOCl2反应的产物为Na2SO3、NaCl可知,SOCl2与水反应生成H2SO3和HCl。(4)由于电池材料易与水、O2反应。
[答案] (1)锂 Li-e-===Li+
(2)2SOCl2+4e-===4Cl-+S+SO2
(3)出现白雾,有刺激性气体生成 SOCl2+H2O===2HCl↑+SO2↑
(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应
12.铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
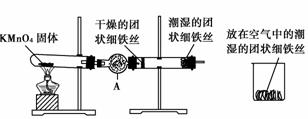
首先检查制氧装置的气密性,然后按上图所示连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②干燥管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面稍有变暗。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于____________。能表示其原理的反应方程式为______________________________________。
(2)仪器A的名称为______________,其中装的药品可以是________,其作用是______________。
(3)由实验可知,该类铁生锈的条件为________________________________________
________________________________________________________________________。
决定铁生锈快慢的一个重要因素是______________。
[解析] 钢铁在潮湿环境下形成原电池,发生电化学腐蚀。此实验在直形管中的现象说明,潮湿是铁生锈的必须前提,而没有涉及潮湿程度对生锈快慢的影响,直形管实验与烧杯实验的对比,则说明O2浓度是影响生锈快慢的一个重要因素。
[答案] (1)电化学腐蚀 负极:2Fe-4e-===2Fe2+
正极:O2+4e-+2H2O===4OH-
(2)球形干燥管 碱石灰(或CaCl2等) 干燥O2
(3)①与O2接触;②与水接触 氧气浓度
11.铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
________________________________________________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应________________,负极反应__________________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤_______________
________________________________________________________________________。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
Fe2+ |
||
|
Cu2+ |
||
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式____________________________________________________
________________________________________________________________________。
劣质不锈钢腐蚀的实验现象________________________________________________。
[解析] (1)该反应是FeCl3氧化金属铜,离子方程式为2Fe3++Cu===2Fe2++Cu2+
(2)将(1)中反应设计成原电池必须是Cu作负极,选择比铜不活泼的金属或碳棒为正极,FeCl3溶液作电解质溶液。装置图如右图所示:
正极:2Fe3++2e-===2F e2+
e2+
负极:Cu-2e-===Cu2+
(3)根据表给出的数据可知,把Cu2+中混有的Fe2+、Fe3+除掉的方法是将Fe2+氧化为Fe3+,调节溶液的pH到3.2-4.7,Fe3+以Fe(OH)3的形式沉淀,过滤除去,根据除杂原则,去杂不能加杂,选择氧化剂为Cl2,加入CuO调节溶液的pH。
(4)根据题给条件,此不锈钢在盐溶液中腐蚀明显,可选择的药品为CuO、浓H2SO4,先用水稀释浓H2SO4再用H2SO4与CuO反应生成CuSO4溶液,不锈钢与CuSO4溶液反应,在不锈钢的表面有紫红色物质生成,即可验证劣质不锈钢易被腐蚀。
[答案] (1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图如下

正极反应:Fe3++e-===Fe2+(或2Fe3++2e-===2Fe2+)
负极反应:Cu===Cu2++2e-(或Cu-2e-===Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2-4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4===CuSO4+H2O
CuSO4+Fe===FeSO4+Cu
不锈钢表面有紫红色物质生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com