
题目列表(包括答案和解析)
10.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是
( )
A.NaOH B.H2SO4
C.AgNO3 D.Na2SO4
[解析] 电解前溶液的pH=a,电解后溶液的pH>a,原溶液显酸性、碱性、中性并不详,但根据pH的变化,可知溶液中c(H+)下降,c(OH-)上升。对于A、B、D选项,均属于电解水类型。溶质浓度均增大,NaOH溶液中c(OH-)上升,符合题意,H2SO4与之相反;Na2SO4溶液pH不变也不符合题意;对于AgNO3溶液,属于放O2生酸型,则pH下降,不符合题意。故选A。
[答案] A
9.下列有关工业生产的叙述正确的是
( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
[解析] A项,将NH3液化分离,可提高N2、H2的转化率,但不能加快正反应速率;B项,是利用SO2氧化为SO3时放出的热来预热即将参加反应的SO2和O2,使其达到适宜于反应的温度;C项,Cl2在阳极室产生;D项,由于阳极为粗铜,较活泼的杂质金属先溶解。
[答案] D
0.010 0mol 1.28 g
[答案] B
8.以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.010 0 mol,则阴极上析出Cu的质量为
( )
A.0.64 g B.1.28 g
C.2.56 g D.5.12 g
[解析] 根据电极反应,阳极:4OH--4e-===2H2O+O2↑
阴极:2Cu2++4e-===2Cu可得出关系式
O2 - 2Cu
1 mol 2×64 g
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O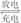
 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
( )
A.放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
[解析] 本题考查了原电池、电解池相关的知识,放电时装置为原电池Zn作负极,充电时,装置变为电解池阳极发生氧化反应,所以A、B正确。放电时正极反应为:FeO+4H2O+3e-===Fe(OH)3↓+5OH-故电极附近溶液的碱性增强,正极所发生的反应为还原而不是氧化,故C错。
[答案] C
6.如右图所示,某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
( )

A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
[解析] 这是一个按照电解饱和食盐水原理设计的趣味实验,根据原理可知电极反应式为
阴极:2H2O+2e-===H2↑+2OH-(发生还原反应)
阳极:2Cl--2e-===Cl2↑(发生氧化反应)
若要能够出现“黑笔写红字”的现象,必须是铅笔作阴极,这样铅笔附近产生的OH-会使酚酞变红。因此与铅笔相连的a点是直流电源的负极。
[答案] D
5.(2008年江苏)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O
 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是
( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
[解析] 本题主要考查原电池的相关知识。电池的充、放电互为相反的过程。充电时作为电解装置,电能转化为化学能,阳极发生氧化反应,电极反应为:Ni(OH)2-e-+OH-===NiOOH+H2O,A正确,B错误。放电时作为原电池装置,化学能转变为电能,负极镉失去电子发生氧化反应,变为Cd2+,吸收OH-,负极周围碱性增强,所以C、D错误。
[答案] A
4. 某同学按下图所示的装置进行电解实验。下列说法正确的是
某同学按下图所示的装置进行电解实验。下列说法正确的是
( )
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
[解析] Cu作阳极被消耗、溶液中H+放电在阴极析出。因此,电解后一段时间c(H+)减小,当生成的CuSO4浓度不断增大后,Cu2+在阴极放电而析出。
[答案] BC
3.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
( )
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-===Cl2↑
D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子
[解析] 两极的反应为阴极:2H++2e-===H2↑;阳极:2Cl--2e-===Cl2↑,Cl2+2Ni2++6OH-===Ni2O3+2Cl-+3H2O,A项铁为活性电极,参与反应,Cl-不能放电,不能生成Cl2;B项阳极OH-被消耗,pH下降。
[答案] CD
2.(2008年海南)关于铅蓄电池的说法正确的是
( )
A.在放电时,正极发生的反应是Pb(s)+SO(aq)-2e-===PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-===Pb(s)+SO(aq)
[解析] A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO+2e-===PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生氧化反应。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com