
题目列表(包括答案和解析)
6.C6H14的各种同分异构体中,所含甲基数和它的一氯取代物的数目与下列情况相符的是
( )
A.4个-CH3,能生成4种一氯代物
B.3个-CH3,能生成5种一氯代物
C.3个-CH3,能生成4种一氯代物
D.2个-CH3,能生成4种一氯代物
[解析] C6H14烷烃中其碳架结构及其一氯取代情况如下:

由以上可知,B、C两选项正确。
[答案] BC
5.两种气态烃0.1 mol,完全燃烧得0.16 mol CO2和3.6 g水,下列说法正确的是
( )
A.混合气体中一定有甲烷
B.混合气体中一定有甲烷和乙烯
C.混合气体中一定没有乙烷
D.混合气体中一定有乙炔
[解析] 因为0.1 mol混合气体完全燃烧生成0.16 mol CO2和3.6 g水。即混合气体的平均化学式为C1.6H4,故混合气体中一定含CH4。因混合气体的平均化学式中含4个氢原子且含甲烷,则另一烃中也一定含4个氢原子,故答案选A、C。
[答案] AC
4.一定量的CH4燃烧后得到的产物是CO、CO2、H2O(g),此混合物的质量为49.6 g,当其缓缓通过足量的无水CaCl2时气体质量减少25.2 g,则混合气中CO的质量为
( )
A.24.4 g B.13.2 g
C.12.5 g D.11.2 g
[解析] 本题通过甲烷在氧气不足的条件下燃烧产物的定量判断,考查学生进行有关有机反应的计算能力。
设产物中CO的物质的量为x,CO2的物质的量为y。
由C原子守恒可得CH4的物质的量为(x+y),又由H原子守恒可得生成H2O的物质的量为2(x+y)。
则
解得x=0.4 mol,y=0.3 mol
m(CO)=0.4 mol×28 g·mol-1=11.2 g。
[答案] D
3.主链含5个碳原子,有甲基、乙基2个支链的烷烃有
( )
A.2种 B.3种
C.4种 D.5种
[解析] 符合题目的同分异构体有


[答案] A
2.将0.2 mol某烷烃完全燃烧后,生成的气体缓缓通入盛有0.5 L 2 mol/L的NaOH溶液中,生成Na2CO3和NaHCO3的物质的量之比为1∶3,则该烷烃为
( )
A.丁烷 B.乙烷
C.甲烷 D.丙烷
[解析] 由题目的条件可写出下列化学方程式:
5NaOH+4CO2===Na2CO3+3NaHCO3+H2O
5 4 1 3
由此化学方程式可知:n(CO2)=0.5 L×2 mol/L×=0.8 mol。又因烷烃为0.2 mol,可知1 mol烷烃中含碳原子物质的量为n(C)=0.8 mol×=4 mol,根据烷烃的通式CnH2n+2,可确定分子式为C4H10。
[答案] A
1.1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
( )
A.  B.CH3CH2CH2CH2CH3
B.CH3CH2CH2CH2CH3
C.
D.


[解析] 1 mol该烃完全燃烧消耗氧气的物质的量为179.2 L/22.4 L·mol-1=8 mol。设该烃的分子式为CxHy则有
x+=8,①
所以x<8。排除D选项,其余三个选项为烷烃,则
y=2x+2。②
解①②可得x=5,y=12,由于该烃的一氯取代物有3种,故选B。
[答案] B
14.下图中每一方框代表一种反应物或生成物:

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
|
|
C |
D |
G |
|
起始 |
3 mol |
1 mol |
0 |
|
3 min时 |
2.4 mol |
0.8 mol |
0.4 mol |
①写出反应②的离子方程式__________________________________________________。
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式______
________________________________________________________________________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________________________________________________________________________。
[解析] (1)X的水溶液可电解,X由M、N两种短周期且同周期元素组成,N元素最高正价与它的最低负价代数和为6,可知N为氯元素,由M原子的最外层电子数比最内层电子数少1,可知M为钠元素;那么X(NaCl)的水溶液电解的产物为:H2、Cl2、NaOH。又有A、B反应生成三种产物,C、B反应生成一种产物,可知B必为Cl2,C必为H2,A必为NaOH。
则反应②的离子方程式为:Cl2+2OH-===Cl-+ClO-+H2O,由题意可知F为HCl,由C为H2,结合题中表格中的数据可知:G为NH3,物质G与F反应生成的盐为NH4Cl。其水溶液中离子浓度由大到小的顺序为:c(Cl-)>c(NH)>c(H+)>c(OH-)。
(2)由B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,可知B为Cu,A为硫酸。那么反应①是电解CuSO4,那么E为SO2,C为O2,D为S。
[答案] (1)Cl2+2OH-===Cl-+ClO-+H2O
c(Cl-)>c(NH)>c(H+)>c(OH-)
(2)2CuSO4+2H2O2Cu+2H2SO4+O2↑
S(s)+O2(g)SO2(g);ΔH=-297.6 kJ·mol-1
13.如下图甲、乙是电化学实验装置。
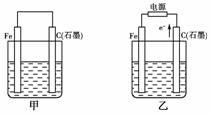
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为____________________________________________;
②乙中总反应的离子方程式为______________________________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_____________________________________________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为______________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
[解析] (1)若两烧杯中均盛有NaCl溶液,则:①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-===4OH-。②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl-+2H2OCl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe-2e-===Fe2+。②乙装置为电解池,电解反应为:2CuSO4+2H2O2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+-CuO-CuCO3,电解后n(H+)=0.1×0.2=0.02 mol,故m(CuO)=0.02××80=0.8 g,m(CuCO3)=0.02××124=1.24 g。
[答案] (1)①O2+2H2O+4e-===4OH-
②2Cl-+2H2O2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O===10HCl+2HIO3
(2)①Fe-2e-===Fe2+
②CuO(或CuCO3) 0.8(或1.24)
12.下图所示为相互串联的甲、乙两电解池,试回答:

(1)若甲池利用电解原理在铁上镀银,则A是________、______________(填电极材料和电极名称),电极反应是______________________;B(要求同A)是__________、__________,电极反应式是______________________________,应选用的电解质溶液是________。
(2)乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈________色,C极附近呈________色。
(3)若甲槽阴极增重43.2 g,则乙槽中阳极上放出的气体在标况下的体积是________mL。
(4)若乙槽中剩余溶液仍为400 mL,则电解后所得溶液的物质的量浓度为________mol·L-1,pH等于________。
[解析] (2)铁极附近H+放电,破坏了附近水的电离平衡,使c(OH-)增大。显一定碱性,遇酚酞呈红色,C极附近Cl-放电,显中性,遇酚酞呈无色。
(3)甲槽阴极析出银:n(Ag)==0.4 mol,乙槽中阳极上放出的气体是氯气:n(Cl2)=0.2 mol,V(Cl2)=0.2 mol×22 400 mL·mol-1=4 480 mL。
(4)由2NaCl+2H2O2NaOH+H2↑+Cl2↑可知:
n(NaOH)=0.2 mol×2=0.4 mol,
c(NaOH)==1 mol·L-1,pH=14。
[答案] (1)铁 阴极 Ag++e-===Ag 银 阳极
Ag-e-===Ag+ AgNO3
(2)红 无 (3)4 480 (4)1 14
11.铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是____________________。
(2)铝与氢氧化钾反应的离子方程式是____________________________________。
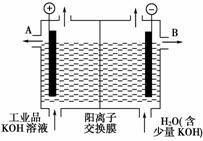 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________________________。
③除去杂质后氢氧化钾溶液从液体出口________(填写“A”或“B”)导出。
[解析] 用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质(含氧酸根),相当于电解水,故电解时的电极反应为:阳极:4OH--4e-===2H2O+O2↑,阴极:4H++4e-===2H2↑。其中阴极区H+放电,H+浓度减小,使水的电离平衡向右移动促进水的电离,OH-浓度增大。在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液。
[答案] (1)2Al2O34Al+3O2↑
(2)2Al+2OH-+2H2O===2AlO+3H2↑
(3)①4OH--4e-===2H2O+O2↑ ②H+放电,促进水的电离,OH-浓度增大 ③B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com