
题目列表(包括答案和解析)
6.(2007年上海)可用下图所示装置制取(必要时可加热)、净化、收集的气体是( )
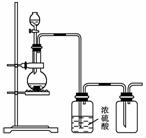
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
[解析] A项NO气体不能用排空气法收集;C项H2的收集应使用向下排空气集气法;D项H2S气体不可以用浓硫酸干燥,因为两者会发生氧化还原反应。
[答案] B
5.右图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是 ( )
 A.大理石和稀硫酸制取二氧化碳
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和水制取乙炔
[解析] A项不能用H2SO4与CaCO3反应制CO2,应用HCl。因CaSO4微溶于水。C项MnO2与浓HCl反应制Cl2需加热。D项电石与水的反应过于剧烈,且反应放热。
[答案] B
4.实验室制取1氯丙烷(沸点46.6 ℃)正确的操作顺序是 ( )
①向蒸馏烧瓶中加入固体氯化钠,再加入1丙醇及浓硫酸混合液,塞好带温度计的木塞 ②将蒸馏烧瓶固定在铁架台上,塞好带温度计的木塞 ③把酒精灯放在铁架台上,根据酒精灯的火焰确定铁圈的高度,固定铁圈,放上石棉网 ④检查装置的气密性 ⑤加热 ⑥通入冷却水
A.④③②①⑤⑥ B.③②④①⑥⑤
C.④③②①⑥⑤ D.③④②①⑤⑥
[解析] 从实验仪器的安装原则去考虑,从下向上,从左到右。
[答案] B
3.某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是
( )
A.Cl2FeCl3FeCl3溶液
B.Cl2HCl盐酸FeCl2溶液FeCl3溶液
C.Cl2HCl盐酸FeCl2溶液FeCl3溶液
D.―→FeCl3溶液
[答案] B
2. (2009年上海单科)1丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125 ℃,反应装置如右图。下列对该实验的描述错误的是 ( )
(2009年上海单科)1丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125 ℃,反应装置如右图。下列对该实验的描述错误的是 ( )
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1丁醇的转化率
[解析] A项,该反应温度为115-125 ℃,超过了100 ℃,故不能用水浴加热。B项,长玻璃管利用空气进行冷凝回流。C项,提纯乙酸丁酯不能用NaOH溶液洗涤,酯在碱性条件下会发生水解反应。D项,增大乙酸的量可提高醇的转化率。
[答案] C
1.(2009年江苏单科)下列有关实验操作的叙述正确的是 ( )

A.实验室常用右图所示的装置制取少量的乙酸乙酯
B.用50 mL酸式滴定管可准确量取25.00 mL KMn O4溶液
C.用量筒量取5.00 mL 1.00 mol·L-1盐酸于50 mL容量瓶中,加水稀释至刻度,可配制0.100 mol·L-1盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
[解析] A项,图中导管不能插入Na2CO3溶液中;B项正确;C项,量筒读数只能精确到小数点后一位;D项,苯密度小于水,有机层应在上层,分液时应从分液漏斗的上口倒出。
[答案] B
14.(2009年全国Ⅰ理综)浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+CCO2↑+2H2O+2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表。并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
[解析] 根据反应原理可知,木炭和浓H2SO4需要在加热的条件下才能进行,故C应作为反应发生装置。在检验产物时必须先检验水,因为在检验其他气体产物会混入水蒸气,故可选用装置B放入无水硫酸铜来检验。SO2对CO2的检验有干扰,必须先检验并除去SO2,最后再检验CO2。
[答案]
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
|
C |
浓H2SO4和木炭 |
反应器(或发生气体) |
|
B |
无水CuSO4 |
检出H2O |
|
A |
品红溶液 |
检出SO2 |
|
A |
酸性KMnO4溶液 |
吸收余下的SO2 |
|
A |
澄清石灰水 |
检出CO2 |
13.某小型化工厂生产皓矾(ZnSO4·7H2O),结晶前的酸性饱和溶液中含有少量的Cu2+、Fe3+、Fe2+等杂质离子。为了除去杂质,获得纯净的皓矾晶体,该工厂设计如下工艺流程:
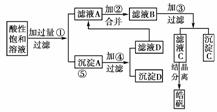
已知:从开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6
Zn(OH)2:5.7-8.0
试回答下列有关问题:
(1)加入的试剂①应是________;主要反应的离子方程式有:__________________。
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20%的H2O2、浓H2SO4、浓HNO3等,应选用________,其理由是_____________。
(3)加入试剂③的目的是______________________。
[解析] 要注意题给信息,试剂③应该是ZnO,既不带入其他杂质又可调节溶液的pH,试剂④应该是硫酸,溶解过量的Zn。
[答案] (1)Zn Zn+Cu2+===Zn2++Cu
Zn+2Fe3+===2Fe2++Zn2+
(2)H2O2 作为氧化剂不带入其他杂质
(3)调节溶液的pH
12.根据图中A、B、C、D四种物质的溶解度曲线,完成下列问题。
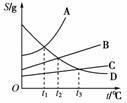
(1)当温度高于0 ℃低于t1 ℃时四种物质溶解度由大到小的顺序是______。
(2)温度在________℃,B、D两物质溶解度相等。
(3)随温度升高,D物质溶解度________。
(4)要想得到四种物质的晶体,A、B采取________方法,C采取________方法,D采取________方法,分离A、C可用________方法。
[解析] (1)0<t<t1时,看曲线所处的位置越高,溶解度越大,故D>A>B>C。(2)两条曲线的交点,两物质溶解度相等,故为t2 ℃。(3)曲线上扬,溶解度随温度升高而升高,下降而降低。(4)溶解度随温度变化大的可降温,而变化小的可蒸发溶剂,A、B降温,C蒸发溶剂,D升温,分离A、C用结晶。
[答案] (1)D>A>B>C (2)t2 (3)降低 (4)降温 蒸发溶剂 升温 结晶
11.某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有____(填代号,限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架 E.泥三角
F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是_______________________________________。
(3)第3步:氧化。操作时依次加入合适的试剂。下列氧化剂最好选用________(填代号)。
A.浓硫酸 B.新制氯水
C.KMnO4溶液 D.H2O2
理由是_____________________________________________。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
[解析] 本题给出实验任务和步骤,考查学生对实验原理的理解,并考查学生根据实验的目的选择正确的试剂操作完成规定“实验”的能力。灼烧固体通常在坩埚中进行,所以涉及的硅酸盐质仪器应有瓷坩埚、酒精灯、泥三角。灼烧所得灰烬含有可溶性I-的盐,欲得其溶液需溶解、过滤,滤液即为含I-的溶液。将I-氧化为I2,以用于第4步的检验,最好选用过氧化氢,因为过氧化氢作氧化剂,还原产物为H2O且无杂质生成,2I-+H2O2+2H+===I2+2H2O,所以再加少量稀酸会促进反应。
[答案] (1)BEF
(2)将灰烬转移到烧杯中,加适量蒸馏水,用玻璃棒充分搅拌,煮沸、过滤
(3)D 过氧化氢是绿色氧化剂,在氧化过程中不引进杂质、不产生污染(不会进一步氧化为单质碘)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com