
题目列表(包括答案和解析)
3.在实验室里不宜长期放置,应在使用时配制的溶液是 ( )
①酚酞试剂 ②银氨溶液 ③Na2CO3溶液 ④氢氧化铜悬浊液 ⑤酸化的FeCl3溶液 ⑥硫化氢水溶液
A.只有②④ B.除①之外
C.只有②④⑥ D.全部
[解析] 银氨溶液不能长期放置,生成易爆物质,Cu(OH)2长期放置易板结,H2S易被氧化。
[答案] C
2.(2008年江苏)香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

丁香酚 香兰素
有关上述两种化合物的说法正确的是 ( )
A.常温下,1 mol丁香酚只能与1 mol Br2反应
B.丁香酚不能与FeCl3溶液发生显色反应
C.1 mol香兰素最多能与3 mol氢气发生加成反应
D.香兰素分子中至少有12个原子共平面
[解析] A项既可发生加成反应,又可发生取代;B项有酚羟基能发生显色反应;C项中的苯环和醛基都能发生加成反应,故应消耗4 mol H2;D项可由苯环共面迁移得出答案。
[答案] D
1.(2009年浙江理综)一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为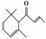 :有关该化合物的下列说法不正确的是 ( )
:有关该化合物的下列说法不正确的是 ( )
A.分子式为C13H20O
B.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2
D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
[解析] A项正确;B项,结构中含有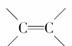 CC,可以发生聚合反应;C项,根据含氧衍生物燃烧通式即O2可计算应消耗17.5
mol O2;D项,αdamascone与Br2反应生成卤代烃,水解得醇与HBr,硝酸酸化后可用AgNO3检验Br-。
CC,可以发生聚合反应;C项,根据含氧衍生物燃烧通式即O2可计算应消耗17.5
mol O2;D项,αdamascone与Br2反应生成卤代烃,水解得醇与HBr,硝酸酸化后可用AgNO3检验Br-。
[答案] C
13.(2007年上海)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
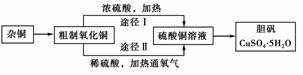
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 ( )
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,称量操作至少进行________次。
(6)若测定结果x值偏高,可能的原因是 ( )
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
[解析] (1)问如果坩埚中的物质冷却时能吸水或易被氧化,则放入干燥器中冷却,如果没有这些要求则放到石棉网上,防止烫坏实验台。
(2)问杂铜中含有大量有机物,如果燃烧不完全则产生具有还原性的物质碳或一氧化碳,在灼烧的过程中可能还原CuO,所以选a。选项b很容易选出。
(3)问要搞清楚题干中过滤的目的,过滤是要滤掉粗制的CuO中不溶于H2SO4的物质,那么后面的两个空不难做答。
(4)问因为粗制的CuO中含有Cu,在加热时与浓H2SO4反应产生SO2,既污染环境,又浪费H2SO4。
(6)问加热温度过高CuSO4分解使x值偏高。颗粒较大分解不完全,放在空气中冷却又吸收水,部分风化已失去部分结晶水,这些因素都造成x值偏低。
[答案] (1)c e b (2)ab (3)蒸发 过滤
(4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气的气体 (5)4 (6)a
12.(2009年上海单科)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
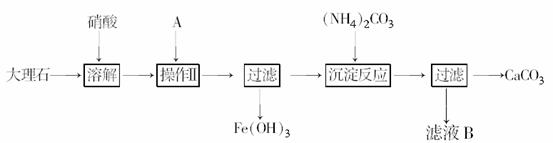 (1)溶解大理石时,用硝酸而不用硫酸的原因是______________________
(1)溶解大理石时,用硝酸而不用硫酸的原因是______________________
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是________________。
(3)写出检验滤液中是否含铁离子的方法: ____________________________________。
(4)写出加入碳酸铵所发生反应的离子方程式:
___________。
写出滤液B的一种用途:________________________________________________________________________。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞
仪器:电子天平、锥形瓶、滴定管
实验步骤:
①__________;②加入__________________;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为______________。
[解析] (1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生。
(2)溶液A应呈碱性且溶质为共价化合物,故溶液A是氨水,目的是除去Fe3+。
(3)Fe3+能与KSCN溶液反应生成红色的Fe(SCN)3,用此原理来检验Fe3+的存在。
(4)滤液B的主要成分是NH4NO3,可用于制造化肥。
(5)首先称量固体的质量,再加入过量的盐酸标准溶液,过量的盐酸再用NaOH标准溶液滴定。
(6)半滴溶液的体积为×= mL,则相对误差为×100%=0.1%。
[答案] (1)硫酸钙微溶于水
(2)除去溶液中Fe3+ 氨水(合理即可)
(3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
(4)Ca2++CO===CaCO3↓ 作化肥(合理即可)
(5)称量 过量的标准盐酸 (6)0.1%
11.(2009年广东单科)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是________________。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是______,现象是__________________。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:__________________;假设2:__________________;假设3:________________________。
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验。按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
… |
|
[解析] (1)根据A中石灰水变浑浊,知有CO2气体,B中有红色固体生成,说明CuO被还原,C中石灰水变浑浊,可知B中CuO被CO还原。
(3)因为题目中说明铁不以三价存在,只能是以二价铁或单质形式,或两者混合物存在。
步骤1:利用K2CO3的溶解性,除去K2CO3;
步骤2:利用铁能置换出Cu,而FeO不能置换出Cu来检验是否含铁单质;
步骤3:利用盐酸酸化分离出FeO,再用H2O2氧化,利用KSCN是否变色,来验证固体中是否含FeO。
[答案] (1)CO2和CO (2)焰色反应 透过蓝色钴玻璃观察到紫色火焰 (3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
③
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 |
固体产物部分溶解 |
|
步骤2:向试管中加入适量CuSO4溶液,再加入少量上述不溶固体,充分振荡 |
(1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体物质生成,则证明有铁单质存在 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN。 |
结合步骤2中的(2); (1)若溶液基本无色,则假设1成立。 (2)若溶液呈血红色,则假设3成立 |
10.将空气缓慢通过下图所示装置后,在试管中收集到少量气体。空气在通过a-d装置时,依次除去的气体是 ( )
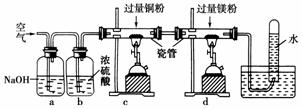
A.O2、N2、H2O、CO2 B.CO2、H2O、O2、N2
C.H2O、CO2、N2、O2 D.N2、O2、CO2、H2O
[解析] 空气依次通过:氢氧化钠溶液(吸收CO2)、浓硫酸(吸收水蒸气)、灼热的过量铜粉(与氧气反应)、灼热的过量镁粉(与N2反应)。
[答案] B
9.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是 ( )
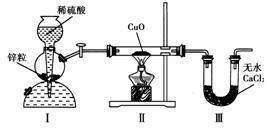
A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
[解析] 解决此类题的关键是分析透彻此实验的反应原理:CuO+H2Cu+H2O,依据反应前后玻璃管的质量差可知生成水中氧元素的质量m(O),U形管的质量差为生成水的质量m(H2O),所以水中氢元素的质量为m(H)=m(H2O)-m(O)。A项因为H2中含有水蒸气,所以m(H2O)的质量偏大,即A可能导致题中结果;B可能吸收空气中的水蒸气即m(H2O)的质量偏大,所以B可能导致题中结果;C选项相当于Ⅱ装置中玻璃管的质量反应后增加了玻璃管内冷凝的水中氢的质量,使m(O)减小,导致误差偏高;D对实验结果无影响。
[答案] D
8.为了检验某无色溶液中是否有SO存在,三位同学分别提出了自己的实验方案。
方案①:试液中加入氯化钡溶液→有白色沉淀→加入足量盐酸,沉淀不消失
方案②:试液中加入稀硝酸溶液,无沉淀→加入硝酸钡溶液→有白色沉淀
方案③:试液中加入足量盐酸,无沉淀→加入氯化钡溶液→有白色沉淀
上述方案中能确认有SO存在的是 ( )
A.只有① B.只有②
C.只有③ D.①②③都可以
[解析] 方案①:试液中加入氯化钡溶液,产生的白色沉淀可能是BaSO4、BaCO3、BaSO3和AgCl等,加入盐酸后,BaCO3、BaSO3可溶解,BaSO4和AgCl不溶解,因此原溶液中可能含有Ag+或SO,该方案不能证明是否含有SO。
方案②:试液中加入稀硝酸溶液,由于硝酸有强氧化性,若溶液中含有SO,将被氧化成SO,因此原溶液中可能含有SO或SO或它们的混合物,该方案也不能证明是否含有SO。
方案③:试液中加入足量盐酸无沉淀,说明原溶液中不含Ag+,再加入氯化钡溶液,由于BaSO3、BaCO3在酸性条件下均不能生成,因此白色沉淀一定是BaSO4。
[答案] C
7.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH、Fe2+、SO和 H2O,下列实验叙述中不正确的是 ( )
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO
D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH
[解析] D项中检验NH时,加入NaOH溶液,加热,能产生NH3,NH3可使试管口湿润的红色石蕊试纸变蓝色,因为氨气遇水能生成显碱性的NH3·H2O。故D不正确。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com