
题目列表(包括答案和解析)
4.在硫酸铁溶液中加入a g铜,完全溶解后,再加入b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是 ( )
A.残余固体全部是铜
B.残余固体可能为铁和铜的混合物
C.残余固体是铁,溶液中一定不含Cu2+
D.最后得到的溶液中可能含Fe3+
[解析] 残留固体中一定含有Cu,由于a>c,说明溶液中一定含有Cu2+,故c g残余固体中不可能含Fe,溶液中也一定不含Fe3+。
[答案] A
3.向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
( )
A.11.2 g B.5.6 g
C.2.8 g D.无法计算
[解析] 依题意,恰好反应后溶液中只存在FeCl2,根据元素守恒法,可建立关系n(Fe)=n(Fe2+)=n(Cl-)=n(HCl)=×0.1 L×1 mol/L=0.05 mol,m(Fe)=2.8 g。
[答案] C
2.把一铁片插入下列溶液中,过一段时间取出,发现铁片的质量减小,且没有气体产生,此溶液是
( )
A.FeSO4 B.Fe2(SO4)3
C.H2SO4 D.CuSO4
[解析] Fe与Fe3+发生反应,形成Fe2+进入溶液,故Fe片质量减轻且无气体放出,Fe与H2SO4反应放出H2,Fe与CuSO4溶液反应,会有Cu析出附着在Fe片上使之质量增重,Fe与FeSO4溶液不发生化学反应,故A、C、D均不符合题意。
[答案] B
1.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
( )
|
|
A |
B |
C |
D |
|
X |
FeCl2溶液 |
FeCl3溶液 |
Fe |
Na2SO4溶液 |
|
Y |
FeCl3 |
CuCl2 |
Al |
Na2CO3 |
|
Z |
Cl2 |
Fe |
NaOH溶液 |
BaCl2溶液 |
[答案] C
21.(13分)(2008年北京理综)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+YZ+W
(1)Y的电子式是____________________。
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是________________________________________________________________________。
(3)用下图所示装置制备NO并验证其还原性。有下列主要操作:

a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是_____________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是
________________________________________________________________________
_③步骤c滴入稀硝酸后烧杯中的现象是______________________________________。
反应的离子方程式是___________________________。
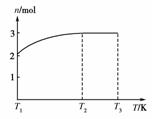 (4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如右图所示。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如右图所示。
①温度在T1-T2之间,反应的化学方程式是_________________________________________________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)____________。
[解析] W为无色液体,初步推断为水,X有5个原子核,可想到CH4、NH,由反应条件知X为NH,反应为:NH+OH-NH3↑+H2O。(2)NH与NH都是10e-微粒。(3)“目的决定过程”,要注意实验目的是“制备并验证NO还原性”。a步骤加NaOH可与生成的P2O5反应,便于观察NO的还原性,2NO+O2===2NO2,体现了NO的还原性,所以步骤c后由止水夹处通入O2。
(4)①注意审题“升高温度至T1的过程中”,故此时的反应为:N2O42NO2。由T1继续升高到T2,气体逐渐变为无色,马上想到,上述反应平衡左移,生成的NO2重新变为N2O4,但随后增大压强,气体逐渐变为红棕色,与上反应的移动方向不一致,所以要变换思路!NO与O2在常温下容易反应生成NO2,高温下可能分解:2NO22NO+O2,再对照物质的量变化,猜想得到了证实。②1 mol N2O4在T2-T3之间变为3 mol气体,故所求为92÷3=30.7。
[答案] (1)[∶···· ∶H]-
(2)2NH3(l)NH+NH
(3)①打开止水夹,通入少量氧气
②P2O5+6OH-===2PO+3H2O
③Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色 3Cu+8H++2NO===3Cu2++2NO↑+4H2O
(4)①2NO22NO+O2 ②30.7
20. (10分)某兴趣小组设计出如右图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(10分)某兴趣小组设计出如右图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活寒b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是______________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL的浓硝酸,c中反应的化学方程式是__________________。
再由a向c中加2 mL蒸馏水,c中的实验现象是___________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________,理由是________________________________________________________________________。
|
方案 |
反应物 |
|
甲 |
Cu、浓HNO3 |
|
乙 |
Cu、稀HNO3 |
|
丙 |
Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为__________,
实验现象为___________________________________,
但此实验的不足之处是_____________________________________。
[解析] (1)连接好一整套装置,关闭分液漏斗活塞,把出气导管液封,加热发生装置,显然是检验装置气密性。
(2)铜片与2 mL浓硝酸反应的化学方程式Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,再加入2 mL蒸馏水,硝酸浓度变稀,降低了反应物浓度使反应减慢,同时产物气体由NO2变NO,故装置中气体颜色变浅。
(3)从题表中制取硝酸铜的三种方案可以看出丙方案消耗反应物硝酸少(只起酸性作用)且不产生污染性气体NO、NO2等显然是体现绿色化学的最佳方案。
(4)要证明氧化性KMnO4>Cl2>Br2可以通过2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O、2KBr+Cl2===2KCl+Br2两个氧化还原反应证明之。具体的操作步骤可以是向d中加KBr(或NaBr),c中加入KMnO4固体,由a向c中加入浓盐酸;c中有黄绿色气体产生,d中溶液会变为黄棕色甚至红棕色,但气体和溶液反应,Cl2不一定完全被吸收,故还需要尾气吸收装置。
[答案] (1)检查装置气密性
(2)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 反应变缓,气体颜色变浅
(3)丙 耗酸量最少,无污染
(4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸 c中有黄绿色气体产生,d中溶液变为黄棕色 没有处理尾气
19.(11分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是______________________。反应完毕经冷却后,②的试管中有大量晶体析出。下图所示中符合该晶体溶解度曲线的是________(填写编号字母);从②的试管中分离出该晶体的方法是________(填写实验操作名称)。

(3)本实验中制取次氯酸钠的离子方程式是________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为________色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为________色 |
|
[解析] (1)浓盐酸属液体试剂,应通过分液漏斗逐滴加入;除Cl2中的HCl,应防止Cl2消耗,排除A、D项,又需吸收HCl,排除C项。
(2)①从题目条件上看:浓度不同,KOH溶液是30%,NaOH溶液是8%;温度不同,KOH溶液需水浴加热,而NaOH溶液却用冰水浴冷却。②“反应完毕经冷却后,②的试管中有大量晶体析出”指明该晶体的溶解度随温度降低而降低,则在“溶解度-温度”图象中,应为增函数曲线。③晶体与液体分离的方法应采用过滤操作。
(3)由氯气与氢氧化钠反应生成次氯酸钠的化学方程式Cl2+2NaOH===NaCl+NaClO+H2O,改写即可。
(4)①“H+使石蕊变色”,溶液呈酸性石蕊应变红。
②石蕊属有色有机物,褪色应考虑漂白作用,是Cl2与水产生的HClO作用的结果。
③持续通入Cl2,会因Cl2溶于水中而使溶液显黄绿色。
[答案] (1)分液漏斗 B
(2)碱溶液(或反应物)的浓度不同,反应温度不同 M 过滤
(3)Cl2+2OH-===ClO-+Cl-+H2O
(4)
|
红 |
|
|
|
氯气与水反应生成的HClO将石蕊氧化为无色物质 |
|
黄绿 |
继续通入的氯气溶于水使溶液呈黄绿色 |
18.(8分)工业上对海水资源综合开发利用的部分工艺流程如图所示。

(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子是________。电解槽中的阳极材料为________。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?________。原因是_______________________________________
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是__________________________________。
[解析] (1)了解离子膜和隔膜的作用;电解槽的阳极材料为不活泼材料。
(2)若按Br2、Mg(OH)2、CaSO4的顺序制备,则CaSO4不可避免的存在于Mg(OH)2中,使产品不纯。
(3)用四氯化碳萃取后还需将CCl4蒸馏出来,工艺复杂、设备投资大、经济效益低、环境污染严重。
[答案] (1)阳离子(或Na+) 钛(或石墨)
(2)否 如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
(3)四氯化碳萃取法工艺复杂、设备投资大;经济效益低,环境污染严重
17.(10分)根据硫酸铜晶体结晶水含量的测定实验;填写下列空白:
(1)此实验操作顺序如下:①称量坩埚、晶体;②加热、冷却;③称量;④______________;⑤________;⑥计算;⑦分析实验误差。
(2)用托盘天平称量的时候,若指针偏向左边,则表示(填写正确选项代码)________。
A.左盘重,样品轻 B.左盘轻,砝码重
C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行加热时,应该用____________来夹持坩埚;为了防止硫酸铜晶体失去结晶水时不完全,或发生CuSO4强热分解,造成实验产生误差,所以在加热操作中要:
①____________________________,②____________________________。
(4)加热后的坩埚应放在__________中冷却。如果放在空气中自然冷却,则会使实验结果的误差__________。
(5)在进行④⑤两步实验时,有时还要重复进行,这是由于
__________________________________________。
[解析] 本实验的操作过程如下:
CuSO4·xH2OxH2O(气体\s\up7(CuSO4
这是定量实验,要保证测量的数据准确,减少实验误差。
[答案] (1)再加热冷却 称量 (2)D
(3)坩埚钳 ①不断用玻璃棒搅拌 ②用小火加热,防止温度过高 (4)干燥器 偏小
(5)保证结晶水完全失去,提高实验的准确度
16.下列有关实验的做法或说法正确的是 ( )
A.在制备乙烯实验中,为防止反应过于剧烈,加热时应使温度缓慢上升至170 ℃
B.向苯酚钠浓溶液中不断通入足量二氧化碳气体,溶液最终不会出现浑浊现象
C.将溴乙烷滴入NaOH溶液后加热,待充分反应后,再加入AgNO3溶液后有浅黄色沉淀生成
D.分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,同时在水浴中加热,三支试管中香味持续时间按加入氢氧化钠、稀硫酸、水的顺序依次增加
[解析] A项,温度应迅速上升到170 ℃;B项苯酚微溶于水,会出现浑浊现象;C项在加入AgNO3溶液之前要先加HNO3酸化。
[答案] D
第Ⅱ卷 (非选择题,52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com