
题目列表(包括答案和解析)
6.正在火星上工作的美国“勇气”号、“机遇”号探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O。以下叙述正确的是
( )
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
B.检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C.分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2∶3∶2
D.明矾属硫酸盐,是纯净物
[解析] 铝热剂应为Al和过渡元素的氧化物所形成的混合物;Fe2O3的检验过程:样品→粉碎→加酸溶解→过滤→向滤液中滴加KSCN溶液;还原相等量的Fe2O3需要的电子的物质的量相等,所以其消耗H2、Al、CO的物质的量之比应为1/2∶1/3∶1/2=3∶2∶3。
[答案] D
5.取14.4 g草酸亚铁(FeC2O4),隔绝空气加热使其完全分解,结果得到7.2 g铁的氧化物,此氧化物的化学式应为
( )
A.Fe2O3 B.FeO
C.Fe3O4 D.FeO·Fe3O4
[解析] 14.4 g FeC2O4中含Fe 0.1 mol 质量5.6 g,则7.2 g铁的氧化物中含氧质量为7.2 g-5.6 g=1.6 g,n(Fe2+)∶n(O2-)=∶=1∶1,化学式为FeO。
[答案] B
4.某种只含铁和氧两元素组成的化合物样品A在高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收过滤,得沉淀的质量是原样品A质量的倍,则下列说法正确的是
( )
A.A一定是Fe3O4
B.A可能是Fe3O4
C.A一定是纯净物
D.可能是FeO与Fe3O4形成的混合物
[解析] 设A的平均化学式为FeOx则
FeOx+xCOFe+xCO2
xCO2+xCa(OH)2===xCaCO3↓+xH2O
故有:= 解得:x=
所以A的平均化学式为Fe3O4,但不一定是Fe3O4,因为有如下可能:①FeO和Fe2O3按物质的量比1∶1组成的混合物;②FeO、Fe2O3和Fe3O4按物质的量比1∶1∶n组成的混合物。
[答案] B
3.有一无色溶液,可能含有K+、Al3+、Mg2+、NH、Cl-、SO、HCO、MnO中的几种。为确定其成分,做如下实验:
①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。
下列推断正确的是
( )
A.肯定有Al3+、Mg2+、NH、Cl-
B.肯定有Al3+、Mg2+、HCO
C.肯定有K+、HCO、MnO
D.肯定有Al3+、Mg2+、SO
[解析] 因溶液无色,所以其中不含MnO,加入Na2O2后产生无色无味的气体,说明原溶液中不含NH,继续加入NaOH,沉淀只有部分溶解,所以其中既含有Mg2+又含有Al3+,由实验②可知原溶液中一定含有SO。
[答案] D
2.将下列每组内的四种物质同时加入到水中,充分搅拌后,既有氧化还原反应发生,又有沉淀产生的一组是(酸均过量)
( )
A.Na2O2、NH4Cl、NaCl、Na2SO4
B.Na2CO3、BaCl2、K2S、盐酸
C.KHCO3、Ca(OH)2、MgCl2、硫酸
D.FeO、AlCl3、Na2SiO3、硝酸
[解析] A中无沉淀。当酸过量时,B中无沉淀,也不发生氧化还原反应。C中最后有CaSO4沉淀,但无氧化还原反应。D中FeO与HNO3发生氧化还原反应,最终产生H2SiO3或H4SiO4沉淀。
[答案] D
1.把镁粉中混入的少量铝粉除去,应选用的试剂是
( )
A.稀盐酸 B.新制氯水
C.烧碱溶液 D.纯碱溶液
[答案] C
14.(1)某科研小组发现某不锈钢材料在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从稀硫酸、NaOH溶液、CuO、Cu中选择两种试剂,设计最佳实验、验证该钢材易在盐溶液中被腐蚀。有关化学方程式是______________________________________,
实验现象是______________。
(2)在(1)答案中选择一个反应设计成原电池。画出该原电池装置图,标出正、负极材料名称并写出正极的电极反应式。
(3)为确认上述原电池反应的氧化产物,取少量反应后的溶液于一支试管中,若出现下列情况通过分析加以说明。
A.若先滴入几滴KSCN溶液,无明显现象,再滴入几滴氯水,溶液立即显血红色,说明________________。
B.若滴入几滴KSCN溶液,溶液立即变成血红色,说明__________________。
C.若先滴入几滴KSCN溶液无明显现象,再滴入几滴氯水,也无明显现象,说明__________________________。
[解析] (1)可设计的实验为铁置换硫酸铜溶液中的铜,而硫酸铜溶液可由氧化铜与硫酸反应得到,故化学方程式为:CuO+H2SO4===CuSO4+H2O,Fe+CuSO4===FeSO4+Cu;由于铜析出附在不锈钢表面,所以观察到有紫红色的物质析出。(2)把Fe+CuSO4===FeSO4+Cu设计成原电池装置,铁应为
负极,碳棒为正极,电解质溶液可用硫酸铜溶液,此时正极的电极反应为:Cu2++2e-===Cu。(3)A.先滴入几滴KSCN溶液,无明显现象,说明不存在Fe3+;再滴入几滴氯水,溶液显血红色,说明此时溶液中存在Fe3+,所以钢铁的氧化产物是Fe2+。B.若滴入几滴KSCN溶液,溶液立即变成血红色,说明溶液中部分Fe2+被空气氧化成Fe3+。C.先滴入几滴KSCN溶液,无明显现象。说明不存在Fe3+;再滴入几滴氯水,溶液不显血红色,说明氯水久置失效。
[答案] (1)CuO+H2SO4===CuSO4+H2O、Fe+CuSO4===FeSO4+Cu 不锈钢表面有紫红色物质析出
(2)原电池装置如下图所示(电极材料名称、正负极符号未标或标错不可。其他合理答案均可)
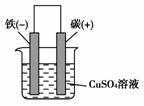
正极反应式为:Cu2++2e-===Cu
(3)A.钢铁的氧化产物是Fe2+
B.溶液中部分Fe2+被空气氧化成Fe3+
C.氯水久置失效
13.某校化学小组学生利用下图所示装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
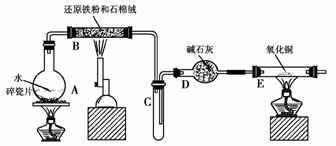
(1)装置B中发生反应的化学方程式是__________________________________。
(2)装置E中的现象是_______________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
________________________________________________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液Cl2IFeCl3溶液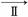 FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是_______________________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:_____________
________________________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)________________________________________________________________________。
[解析] 本题是以铁的性质为载体设计的一道综合性实验题,既考查了元素化合物的知识又考查了实验的原理、操作。
铁与水反应的产物为Fe3O4和H2用来还原CuO,Fe3O4用来制取FeCl3·6H2O晶体,通Cl2是为了将Fe2+氧化成Fe3+,在操作中要注意Fe3+水解问题。
[答案] (1)3Fe+4H2O(g)Fe3O4+4H2
(2)黑色固体变红,右端管壁有水珠
(3)取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
(4)①将Fe2+氧化成Fe3+ ②加热浓缩,冷却结晶,过滤
③Fe3++3H2O
 Fe(OH)3+3H+,过量盐酸抑制FeCl3水解
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解
12.(2008年江苏)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
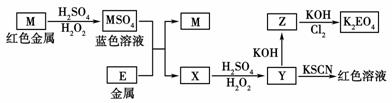
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:_________________________
________________________________________________________________________。
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:_____________________________________________________。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:____________________________________。
[解析] 本题以简单的框图推断为背景,考查图中涉及的几个重要的氧化还原反应的方程式、离子方程式的书写以及相关物质的结构问题。
(1)借助图中“红色金属到蓝色溶液”这一信息,可判断M为Cu,方程式:Cu+H2O2+H2SO4===CuSO4+2H2O;
(2)借助Y遇KSCN出现红色溶液,而Y是由X氧化而来,则推知E为Fe,X为FeSO4,Y为Fe2(SO4)3,所以离子反应为:4Fe2++O2+4H+===4Fe3++2H2O;2Fe3++2I-===2Fe2++I2;(3)根据上述分析,则Z为Fe(OH)3,K2EO4为高铁酸钾,反应式为:10KOH+3Cl2+2Fe(OH)3===2K2FeO4+6KCl+8H2O。
[答案] (1)Cu+H2O2+H2SO4===CuSO4+2H2O
(2)4Fe2++O2+4H+===4Fe3++2H2O
2Fe3++2I-===2Fe2++I2
(3)10KOH+3Cl2+2Fe(OH)3===2K2FeO4+6KCl+8H2O
11.A-I分别表示中学化学中常见的一种物质,它们之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
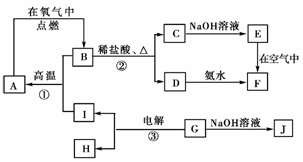
已知:A、B、C、D、E、F六种物质中均含有同一种元素;G为主族元素的固态化合物。
(1)写出物质的化学式:
E________,F________,J________。
(2)写出反应的化学方程式:
①______________________________;
②______________________________;
③______________________________。
[解析] C与NaOH溶液反应得E,且E在空气中转变为F。结合学过Fe(OH)2到Fe(OH)3的转化,推测E为Fe(OH)2,F为Fe(OH)3。又因A、B、C、D、E、F六种物质中均含有同一种元素,故C为FeCl2,D为FeCl3,B中含铁元素,但B中既有Fe2+,又有Fe3+,所以B为Fe3O4,A为Fe。G为主族元素的固态化合物,能电解,且与NaOH能反应生成J,所以G为Al2O3,反应①为铝热反应。
[答案] (1)Fe(OH)2 Fe(OH)3 NaAlO2
(2)①3Fe3O4+8Al9Fe+4Al2O3
②Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
③2Al2O34Al+3O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com