
题目列表(包括答案和解析)
16.(2007年江苏)某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
( )
A.若金属剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a和b的关系没法确定
[解析] A项,溶液中还含有NO。B项,Fe3+是否含有取决于Fe和HNO3的量。C项,溶液中还含有NO。D项,由于溶液中只有Fe3+、Cu2+说明HNO3足量。故其浓度可由下面两反应求得:Fe+4HNO3===Fe(NO3)3+NO↑+2H2O;3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O。
[答案] A
第Ⅱ卷 (非选择题,52分)
15.某研究性学习小组探索镁粉与FeCl3溶液反应机理,做了如下两组实验:
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀。则下列有关镁与FeCl3溶液反应的叙述中正确的是
( )
A.镁只与FeCl3溶液中的Fe3+直接反应
B.气泡是由镁与FeCl3溶液中的水直接反应产生的
C.红褐色沉淀是由镁与水反应生成的Mg(OH)2与Fe3+反应所得到的
D.气泡是由镁与FeCl3水解产生的盐酸反应生成的
[解析] FeCl3水溶液呈弱酸性是因为FeCl3水解产生盐酸:FeCl3+3H2OFe(OH)3+3HCl;而加入镁粉,Mg和盐酸反应产生H2,故有气泡产生;溶液颜色变浅是因为另有一部分镁粉被Fe3+氧化:2Fe3++Mg===2Fe2++Mg2+;红褐色沉淀的出现是由于Mg与盐酸反应,使Fe3+水解平衡正向移动的结果。
[答案] D
14.下列叙述中,正确的是
( )
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
[解析] 船舶的外壳装上铜块形成原电池,铁作为负极而被腐蚀,A错;FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧分别得到Fe2O3、Fe2(SO4)3,C错;用惰性电极电解MgCl2溶液得到Mg(OH)2、H2和Cl2,D错。
[答案] B
13.如右图所示,向一定量的铁粉中加入一定体积12 mol·L-1的硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是
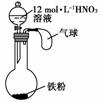
①NO ②Fe3+ ③H+ ④NO ⑤NO2
A.只有① B.①⑤
C.②④⑤ D.①②③⑤
[解析] 题中给出的12 mol·L-1的硝酸是浓硝酸,如果铁少则生成Fe3+,如果铁过量则生成Fe2+,溶液中一定有NO,烧瓶中的气体一定有NO2,H+、NO不一定有。
[答案] B
12.FeCl3溶液与下列物质的反应,其中与Fe3+的水解无关的一组是
( )
①紫色石蕊试液 ②碘化钾 ③煮沸的蒸馏水 ④硫化氢 ⑤苯酚钠溶液 ⑥铜粉 ⑦小苏打溶液 ⑧镁粉
A.②④⑧ B.①②④
C.③⑧ D.②④⑤⑥
[解析] Fe3+水解呈酸性,使紫色石蕊试液显红色;I-与Fe3+发生氧化还原反应2Fe3++2I-===2Fe2++I2,与Fe3+的水解无关;Fe3++3H2OFe(OH)3(胶体)+3H+,与Fe3+的水解有关;H2S与Fe3+发生氧化还原反应,与Fe3+的水解无关;苯酚钠遇Fe3+显紫色,与Fe3+的水解无关;Cu+2Fe3+===Cu2++2Fe2+,与Fe3+的水解无关;小苏打溶液中的HCO与Fe3+发生双水解;镁粉加入到FeCl3溶液中有气泡冒出,这是因为Fe3+水解显酸性。故与Fe3+的水解有关的是①③⑦⑧,无关的是②④⑤⑥。
[答案] D
11.往100 mL 3 mol/L的稀硝酸中加入一定量的铁铜混合粉末,充分反应后过滤,再往滤渣中滴入稀盐酸,发现有氢气产生,则滤液中
( )
A.一定含Fe2+、不含Fe3+和Cu2+
B.含Fe3+、不含Cu2+、可能含Fe3+
C.可能含Fe2+、Fe3+和Cu2+
D.可能含Fe3+和Cu2+、不含Fe2+
[解析] 铜和铁与稀硝酸反应分别生成Cu2+和Fe3+,往滤渣中滴入稀盐酸,发现有氢气产生说明Fe过量,故反应后的溶液中将不可能存在Cu2+和Fe3+。
[答案] A
10.诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼金属钼的化学原理为:
①2MoS2+7O22MoO3+4SO2;②MoO3+2NH3·H2O===(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl===H2MoO4↓+2NH4Cl;④H2MoO4MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
( )
A.MoS2煅烧的尾气可以直接排入空气中
B.MoO3既是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和Al还原等质量的MoO3,所消耗的还原剂的物质的量之比为3∶3∶2
[解析] SO2是大气污染物,不能直接排入空气中,A选项错误;由反应④知MoO3是H2MoO4的酸酐,B选项错误;由反应③和复分解反应制酸的原理知H2MoO4是弱酸,C选项错误;22O,O2, O3,还原等质量的MoO3即失去电子数相等,所以D选项正确。
[答案] D
9.下列金属或氧化物可以完全溶解的是
( )
A.1 mol Zn与含1 mol HCl的稀盐酸共热
B.1 mol Cu与含2 mol H2SO4的浓硫酸共热
C.1 mol Cu与含4 mol HNO3的浓硝酸共热
D.1 mol MnO2与含4 mol HCl的浓盐酸共热
[解析] A项中盐酸的量不足,不能完全溶解;B项中理论上可以,但当浓硫酸变为稀硫酸时,反应不再进行,不能完全溶解;D项中理论上浓盐酸和MnO2恰好完全反应,但当浓盐酸变为稀盐酸时,反应不再进行。
[答案] C
8.下列实验中,溶液颜色有明显变化的是
( )
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO4溶液中
D.往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
[解析] 在A选项中,反应前后,溶液都为无色。在B选项中,向棕黄色的FeCl3溶液中滴加无色的KI溶液,由于Fe3+能将I-氧化成I2,再加淀粉溶液后,溶液变蓝。在C选项中,NaHSO4溶液无色,(实质是其中的水)与Na2O2固体反应后,生成Na2SO4,所以溶液前后均无色。在D选项中,两者不反应,所以除稀释外没有明显的颜色的改变。
[答案] B
7.下列关于金属的一些说法不正确的是
( )
A.金属冶炼的本质是金属阳离子得到电子变成金属原子
B.工业上金属Mg、Al都是用电解法得到
C.越活泼的金属越难冶炼
D.金属的化合价越低越难冶炼
[解析] 越活泼的金属越难冶炼,与金属的化合价高低无关。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com