
题目列表(包括答案和解析)
1.(2008年上海)取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直接电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是
( )
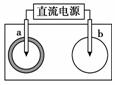
A.b电极是阴极
B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
[解析] 根据题意,a电极应产生Cl2,为阳极,与电源正极相连,则b为阴极。D项中b电极上H+放电,附近OH-浓度增大,pH变大。
[答案] D
14.(2009年天津理综)氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
(1)氢氧燃料电池的能量转化主要形式是
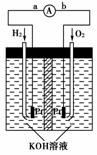
________________________________________________________________________,
在导线中电子流动方向为__________________________(用a、b表示)。
(2)负极反应式为___________________________________________________________。
(3)电极表面镀铂粉的原因为_______________________________________________
________________________________________________________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H22LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是__________,反应Ⅱ中的氧化剂是____________。
②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为______mol。
[解析] (1)电池即是把化学能转变为电能的装置;在电池中电子是从负极经导线流向正极,而氢氧燃料电池中通入H2的一极是负极,故电子由a流动到b。(2)H2在负极失电子,因为电解质溶液是KOH溶液,故负极反应式为2H2+4OH--4e-===4H2O。(3)电极表面镀铂粉可以增大电极单位面积吸附H2、O2的分子数,从而增大反应速率。(4)LiH中Li为+1价,H为-1价故反应Ⅰ中还原剂是Li,反应Ⅱ中氧化剂是H2O。由反应Ⅰ可知吸收标准状况下224 L H2时生成160 g LiH,则生成的LiH的体积是,则生成的LiH体积与被吸收的H2的体积比为:=。由②生成的20 mol LiH与H2O反应,由反应Ⅱ可知生成20 mol H2,H2-2e-,能量转化率为80%,则通过电子的物质的量为20 mol×2×80%=32 mol。
[答案] (1)由化学能转变为电能 由a到b
(2)2H2+4OH--4e-===4H2O或H2+2OH--2e-===2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
(4)①Li H2O ②1/1 148或8.71×10-4 ③32
13.(2009年海南单科)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为______________,发生的电极反应为________________;
(2)电池正极发生的电极反应为_______________________________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是__________________________________,反应的化学方程式为______________________________________;
(4)组装该电池必须在无水、无氧的条件下进行,原因是________________________
________________________________________________________________________。
[解析] (1)、(2)电池负极发生氧化反应,正极发生还原反应。(3)由NaOH与SOCl2反应的产物为Na2SO3、NaCl可知,SOCl2与水反应生成H2SO3和HCl。(4)由于电池材料易与水、O2反应。
[答案] (1)锂 Li-e-===Li+
(2)2SOCl2+4e-===4Cl-+S+SO2
(3)出现白雾,有刺激性气体生成 SOCl2+H2O===2HCl↑+SO2↑
(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应
12.铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
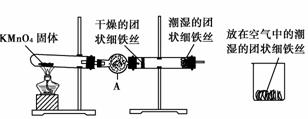
首先检查制氧装置的气密性,然后按上图所示连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②干燥管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面稍有变暗。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于____________。能表示其原理的反应方程式为______________________________________。
(2)仪器A的名称为______________,其中装的药品可以是________,其作用是______________。
(3)由实验可知,该类铁生锈的条件为________________________________________
________________________________________________________________________。
决定铁生锈快慢的一个重要因素是______________。
[解析] 钢铁在潮湿环境下形成原电池,发生电化学腐蚀。此实验在直形管中的现象说明,潮湿是铁生锈的必须前提,而没有涉及潮湿程度对生锈快慢的影响,直形管实验与烧杯实验的对比,则说明O2浓度是影响生锈快慢的一个重要因素。
[答案] (1)电化学腐蚀 负极:2Fe-4e-===2Fe2+
正极:O2+4e-+2H2O===4OH-
(2)球形干燥管 碱石灰(或CaCl2等) 干燥O2
(3)①与O2接触;②与水接触 氧气浓度
11.铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
________________________________________________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应________________,负极反应__________________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤_______________
________________________________________________________________________。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
Fe2+ |
||
|
Cu2+ |
||
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式____________________________________________________
________________________________________________________________________。
劣质不锈钢腐蚀的实验现象________________________________________________。
[解析] (1)该反应是FeCl3氧化金属铜,离子方程式为2Fe3++Cu===2Fe2++Cu2+
(2)将(1)中反应设计成原电池必须是Cu作负极,选择比铜不活泼的金属或碳棒为正极,FeCl3溶液作电解质溶液。装置图如右图所示:
正极:2Fe3++2e-===2F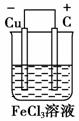 e2+
e2+
负极:Cu-2e-===Cu2+
(3)根据表给出的数据可知,把Cu2+中混有的Fe2+、Fe3+除掉的方法是将Fe2+氧化为Fe3+,调节溶液的pH到3.2-4.7,Fe3+以Fe(OH)3的形式沉淀,过滤除去,根据除杂原则,去杂不能加杂,选择氧化剂为Cl2,加入CuO调节溶液的pH。
(4)根据题给条件,此不锈钢在盐溶液中腐蚀明显,可选择的药品为CuO、浓H2SO4,先用水稀释浓H2SO4再用H2SO4与CuO反应生成CuSO4溶液,不锈钢与CuSO4溶液反应,在不锈钢的表面有紫红色物质生成,即可验证劣质不锈钢易被腐蚀。
[答案] (1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图如下
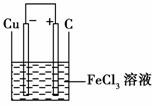
正极反应:Fe3++e-===Fe2+(或2Fe3++2e-===2Fe2+)
负极反应:Cu===Cu2++2e-(或Cu-2e-===Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2-4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4===CuSO4+H2O
CuSO4+Fe===FeSO4+Cu
不锈钢表面有紫红色物质生成
21.(12分)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下图所示
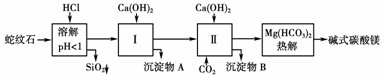
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________________。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致______溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入________(填入物质的化学式),然后____________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是____________________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③________________________________________________
④____________________________ ⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:a=____________________,b=________________,c=______________。
[解析] (1)四种氧化物中只有SiO2不溶于盐酸。MgO+2HCl===MgCl2+H2O;Fe2O3+6HCl===2FeCl3+3H2O,Al2O3+6HCl===2AlCl3+3H2O。
(2)由沉淀表可知控制pH=7-8时,Fe3+、Al3+均与Ca(OH)2生成Fe(OH)3、Al(OH)3。若Ca(OH)2过量,碱性增强,pH>9.4时,Mg2+会变为Mg(OH)2沉淀,而又会发生Al(OH)3+OH-===AlO+2H2O使Al(OH)3溶解。
(3)沉淀物A为Fe(OH)3与Al(OH)3,由其性质可知,要分离出红色氧化物颜料为Fe2O3,则需加过量NaOH,将Al(OH)3溶解,然后依据固液分离和固体灼烧的方法回答,发生2Fe(OH)3Fe2O3+3H2O反应而得。
(4)Ⅱ中生成的沉淀B为CaCO3,高温煅烧可生成CO2,2Mg(HCO3)2Mg2(OH)2CO3+3CO2↑+H2O也产生CO2,可循环利用。
(5)见答案
(6)据元素守恒可知:n(CO2)=n(MgCO3)==0.15 mol。镁元素守恒可知:n[Mg(OH)2]=n(MgO)-n(MgCO3)=-0.15 mol=0.05 mol。根据前后质量守恒可求n(H2O)=0.15 mol,则a∶b∶c=3∶1∶3,即为最小整数比,可得。
[答案] (1)Fe3+、Al3+
(2)Al(OH)3 Mg(OH)2
(3)NaOH或Ca(OH)2 过滤、洗涤、灼烧
(4)CaCO3或CO2
(5)③用浓硫酸吸收水蒸气 ④称量碱石灰吸收CO2前后的质量 (6)3 1 3
20.(12分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是____________________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是_______________________________________
________________________________________________________________________。
(3)③中所发生的各反应的离子方程式是______________________________________
________________________________________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
[答案] (1)加少量KClO3,插上Mg条并将其点燃 Fe
(2)Fe2O3+6HCl===2FeCl3+3H2O MgO+2HCl===MgCl2+H2O
(3)Fe+2H+===Fe2++H2↑ Fe+2Fe3+===3Fe2+
(4)0.67 mol·L-1 2.3 mol·L-1
19.(10分)已知:2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是______________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是______________,其对应的氧化产物的物质的量分别是__________________________________________________________。
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为________(用含a、b的代数式表示)。
[解析] (1)混合溶液中可被Cl2氧化的离子,n(I-)=2 mol,n(Fe2+)=3 mol,n(Br-)=4 mol,由于n(Cl2)=2 mol,显然不能将溶液中具有还原性的离子都氧化,则要按I->Fe2+>Br-来进行,被氧化的离子的物质的量按得失电子守恒计算;
(2)原理、方法与(1)同;(3)根据得失电子守恒2n(Cl2)=3n(FeI2)+3n(FeBr2)
得n(Cl2)=
即c==1.5(a+b)
[答案] (1)I-、Fe2+ 2 mol、2 mol
(2)I-、Fe2+、Br- 1 mol、3 mol、0.5 mol (3)1.5(a+b)
18.(12分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适反应条件下,它们可以按下图进行反应。又知E溶液是无色的,请回答:
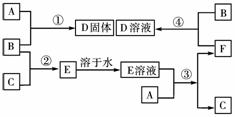
(1)A是________,B是________,C是________。(请填化学式)
(2)反应①的化学方程式为:____________________________________________。
(3)反应③的化学方程式为:____________________________________________。
(4)反应④的化学方程式为:____________________________________________。
[解析] B为黄绿色气体,则B为Cl2,C为无色气体,且能与Cl2反应,产物为E,E溶于水后又能和固体A反应,重新生成无色气体C,初步推测C为H2,E为HCl,A为金属单质。F为金属氯化物。据F+BD。而D是A和Cl2反应得到的金属氯化物,推断A为变价金属(Fe或Cu),结合A与盐酸反应能制取H2,故A为Fe,B为Cl2,C为H2,其他物质依次可推出。
[答案] (1)Fe Cl2 H2
(2)2Fe+3Cl22FeCl3
(3)Fe+2HCl===FeCl2+H2↑
(4)2FeCl2+Cl2===2FeCl3
17.(6分)某地污水中含有Zn2+、Hg2+、Fe3+、Cu2+4种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下图所示:(提示:Zn(OH)2溶于NaOH溶液)。
甲 +NaOH溶液,过滤①△②+H2,△③
乙 △②+H2,△③
丙 +过量铁粉,过滤①+稀盐酸,过滤②
△③++H2,△④
(1)三种实验方案中能制得纯净铜的方案是________。
(2)在能制得纯净铜的方案中,会导致环境污染的操作步骤是________,污染原因是________________________________________________________________________,
改进方法是__________________________________________________________。
[解析] 甲方案污水中加NaOH所得溶液中存在Cu2+、Fe3+、Hg2+的氢氧化物,加热分解后得到Fe2O3、CuO,用H2还原后制得的Cu不纯净,且产生汞蒸气污染环境。
乙方案加入过量铁粉所得残渣中会残留铁,直接加热,还原所制得的铜不纯,同时产生Hg的污染。
只有丙方案以上两个方面均考虑到了,制得的铜是纯净的,但丙方案中会产生汞蒸气,有毒,污染环境,应增加冷凝装置加以回收、利用。
[答案] (1)丙 (2)③ Hg挥发变成蒸气,Hg蒸气有毒 加上冷凝装置,将气态Hg变成液态Hg而回收
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com