
题目列表(包括答案和解析)
1.1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
( )
A.  B.CH3CH2CH2CH2CH3
B.CH3CH2CH2CH2CH3
C.
D.
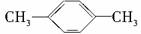
[解析] 1 mol该烃完全燃烧消耗氧气的物质的量为179.2 L/22.4 L·mol-1=8 mol。设该烃的分子式为CxHy则有
x+=8,①
所以x<8。排除D选项,其余三个选项为烷烃,则
y=2x+2。②
解①②可得x=5,y=12,由于该烃的一氯取代物有3种,故选B。
[答案] B
14.下图中每一方框代表一种反应物或生成物:
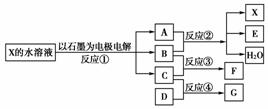
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
|
|
C |
D |
G |
|
起始 |
3 mol |
1 mol |
0 |
|
3 min时 |
2.4 mol |
0.8 mol |
0.4 mol |
①写出反应②的离子方程式__________________________________________________。
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式______
________________________________________________________________________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________________________________________________________________________。
[解析] (1)X的水溶液可电解,X由M、N两种短周期且同周期元素组成,N元素最高正价与它的最低负价代数和为6,可知N为氯元素,由M原子的最外层电子数比最内层电子数少1,可知M为钠元素;那么X(NaCl)的水溶液电解的产物为:H2、Cl2、NaOH。又有A、B反应生成三种产物,C、B反应生成一种产物,可知B必为Cl2,C必为H2,A必为NaOH。
则反应②的离子方程式为:Cl2+2OH-===Cl-+ClO-+H2O,由题意可知F为HCl,由C为H2,结合题中表格中的数据可知:G为NH3,物质G与F反应生成的盐为NH4Cl。其水溶液中离子浓度由大到小的顺序为:c(Cl-)>c(NH)>c(H+)>c(OH-)。
(2)由B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,可知B为Cu,A为硫酸。那么反应①是电解CuSO4,那么E为SO2,C为O2,D为S。
[答案] (1)Cl2+2OH-===Cl-+ClO-+H2O
c(Cl-)>c(NH)>c(H+)>c(OH-)
(2)2CuSO4+2H2O2Cu+2H2SO4+O2↑
S(s)+O2(g)SO2(g);ΔH=-297.6 kJ·mol-1
13.如下图甲、乙是电化学实验装置。
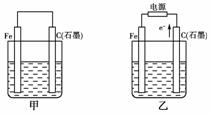
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为____________________________________________;
②乙中总反应的离子方程式为______________________________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_____________________________________________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为______________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
[解析] (1)若两烧杯中均盛有NaCl溶液,则:①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-===4OH-。②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl-+2H2OCl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe-2e-===Fe2+。②乙装置为电解池,电解反应为:2CuSO4+2H2O2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+-CuO-CuCO3,电解后n(H+)=0.1×0.2=0.02 mol,故m(CuO)=0.02××80=0.8 g,m(CuCO3)=0.02××124=1.24 g。
[答案] (1)①O2+2H2O+4e-===4OH-
②2Cl-+2H2O2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O===10HCl+2HIO3
(2)①Fe-2e-===Fe2+
②CuO(或CuCO3) 0.8(或1.24)
12.下图所示为相互串联的甲、乙两电解池,试回答:
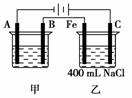
(1)若甲池利用电解原理在铁上镀银,则A是________、______________(填电极材料和电极名称),电极反应是______________________;B(要求同A)是__________、__________,电极反应式是______________________________,应选用的电解质溶液是________。
(2)乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈________色,C极附近呈________色。
(3)若甲槽阴极增重43.2 g,则乙槽中阳极上放出的气体在标况下的体积是________mL。
(4)若乙槽中剩余溶液仍为400 mL,则电解后所得溶液的物质的量浓度为________mol·L-1,pH等于________。
[解析] (2)铁极附近H+放电,破坏了附近水的电离平衡,使c(OH-)增大。显一定碱性,遇酚酞呈红色,C极附近Cl-放电,显中性,遇酚酞呈无色。
(3)甲槽阴极析出银:n(Ag)==0.4 mol,乙槽中阳极上放出的气体是氯气:n(Cl2)=0.2 mol,V(Cl2)=0.2 mol×22 400 mL·mol-1=4 480 mL。
(4)由2NaCl+2H2O2NaOH+H2↑+Cl2↑可知:
n(NaOH)=0.2 mol×2=0.4 mol,
c(NaOH)==1 mol·L-1,pH=14。
[答案] (1)铁 阴极 Ag++e-===Ag 银 阳极
Ag-e-===Ag+ AgNO3
(2)红 无 (3)4 480 (4)1 14
11.铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是____________________。
(2)铝与氢氧化钾反应的离子方程式是____________________________________。
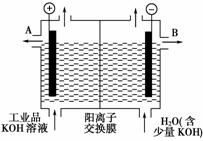 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________________________。
③除去杂质后氢氧化钾溶液从液体出口________(填写“A”或“B”)导出。
[解析] 用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质(含氧酸根),相当于电解水,故电解时的电极反应为:阳极:4OH--4e-===2H2O+O2↑,阴极:4H++4e-===2H2↑。其中阴极区H+放电,H+浓度减小,使水的电离平衡向右移动促进水的电离,OH-浓度增大。在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液。
[答案] (1)2Al2O34Al+3O2↑
(2)2Al+2OH-+2H2O===2AlO+3H2↑
(3)①4OH--4e-===2H2O+O2↑ ②H+放电,促进水的电离,OH-浓度增大 ③B
10.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是
( )
A.NaOH B.H2SO4
C.AgNO3 D.Na2SO4
[解析] 电解前溶液的pH=a,电解后溶液的pH>a,原溶液显酸性、碱性、中性并不详,但根据pH的变化,可知溶液中c(H+)下降,c(OH-)上升。对于A、B、D选项,均属于电解水类型。溶质浓度均增大,NaOH溶液中c(OH-)上升,符合题意,H2SO4与之相反;Na2SO4溶液pH不变也不符合题意;对于AgNO3溶液,属于放O2生酸型,则pH下降,不符合题意。故选A。
[答案] A
9.下列有关工业生产的叙述正确的是
( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
[解析] A项,将NH3液化分离,可提高N2、H2的转化率,但不能加快正反应速率;B项,是利用SO2氧化为SO3时放出的热来预热即将参加反应的SO2和O2,使其达到适宜于反应的温度;C项,Cl2在阳极室产生;D项,由于阳极为粗铜,较活泼的杂质金属先溶解。
[答案] D
0.010 0mol 1.28 g
[答案] B
8.以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.010 0 mol,则阴极上析出Cu的质量为
( )
A.0.64 g B.1.28 g
C.2.56 g D.5.12 g
[解析] 根据电极反应,阳极:4OH--4e-===2H2O+O2↑
阴极:2Cu2++4e-===2Cu可得出关系式
O2 - 2Cu
1 mol 2×64 g
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
( )
A.放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
[解析] 本题考查了原电池、电解池相关的知识,放电时装置为原电池Zn作负极,充电时,装置变为电解池阳极发生氧化反应,所以A、B正确。放电时正极反应为:FeO+4H2O+3e-===Fe(OH)3↓+5OH-故电极附近溶液的碱性增强,正极所发生的反应为还原而不是氧化,故C错。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com