
题目列表(包括答案和解析)
5.关于某无色溶液中所含离子的鉴别,下列判断正确的是 ( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在
B.通入Cl2后,溶液变为棕黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有SO存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO存在
[解析] Cl-、SO均能与Ag+形成不溶于稀盐酸的白色沉淀,A错;I2遇淀粉变蓝,通入Cl2后,溶液变为棕黄色,加入淀粉溶液后溶液变蓝,则溶液中有I-存在,B对;SO与Ba(NO3)2反应形成的BaSO3沉淀在加入稀盐酸时会转化为BaSO4沉淀,C错;能使澄清石灰水变浑浊的气体是CO2或SO2,原溶液中可能存在的离子是CO、HCO、SO或HSO,D错。
[答案] B
4.下列符合化学实验“绿色化”的有 ( )
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 ②在铜与浓硫酸反应的实验中,将铜片改为可调节高度的铜丝 ③将实验室的废酸液与废碱液中和后再排放
A.①② B.①③
C.②③ D.①②③
[解析] 因为溴易挥发,所以在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水。在铜与浓硫酸反应的实验中为避免生成过量的SO2污染空气,将铜片改为可调节高度的铜丝。将实验室的废酸液与废碱液中和后再排放,可减少水体污染。
[答案] D
3.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊。再升温至65
℃以上,溶液变澄清 |
C6H5ONa 溶液 |
|
B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失 |
Na2SiO3 溶液 |
|
C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去 |
Ca(ClO)2 溶液 |
|
D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊 |
Ca(OH)2 溶液 |
[解析] A项,CO2+C6H5ONa―→C6H5OH+NaHCO3,升温至65 ℃以上,C6H5OH完全溶解,溶液变澄清。B项,CO2+Na2SiO3+H2O===Na2CO3+H2SiO3↓,H4SiO4与CO2不反应,浑浊不会消失。C项,CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO,所以溶液变浑浊。加入品红,被HClO氧化褪色。D项,首先,CO2+Ca(OH)2===CaCO3↓+H2O,继续通CO2,产生可溶于水的Ca(HCO3)2,再加入足量的NaOH,则:2NaOH+Ca(HCO3)2===CaCO3↓+Na2CO3+2H2O,溶液又变浑浊。
[答案] B
2.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①,②,③,④是 ( )
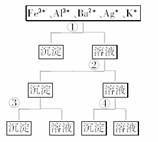
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
[解析] 从题图所示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀。第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3·H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离。第④步用SO将Ba2+和K+分离,故答案为D。
[答案] D
1.(2008年新课程)下列除去杂质的方法正确的是 ( )
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
[解析] A项中灼热的CuO不能除去O2。B项中碳酸钠溶液在除去HCl的同时,也和CO2反应,生成碳酸氢钠。D项中加入NaOH虽然可以把氯化镁除去,但同时又生成了氯化钠,引入了新的杂质,不合题意。
[答案] C
14.(2009年宁夏理综)碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式
________________________________________________________________________。
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)

③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为________g,化学式为______________。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
[解析] (1)①与H2反应的化学方程式,利用氧化还原反应原理,把金属Cu还原出来,碳元素变成CO2,氢元素变成水。
②仪器连接时,洗气瓶要“长进短出”,其中水是观察H2生成速率的。
③残留固体一定是Cu,则n(Cu)==0.2(mol),根据题意,n(CO2)=n(CuCO3)==0.1(mol),所以,m(CuCO3)=123.5×n(CuCO3)=12.35(g),m[Cu(OH)2]=97.5×[n(Cu)-n(CuCO3)]=9.75(g),m(结晶水)=23.9-12.35-9.75=1.8(g)。该碱式碳酸铜化学式为CuCO3·Cu(OH)2·H2O。
(2)根据xCuCO3·yCu(OH)2·zH2O(x+y)CuO+xCO2↑+(y+z)H2O↑,依据元素守恒和质量守恒,即可得出答案。
[答案] (1)①xCuCO3·yCu(OH)2·zH2O+(x+y)H2(x+y)Cu+xCO2+(x+2y+z)H2O
②a→kj→gf(或hi)→de(或ed)→hi(或gf)→bc(或cb)→l
③1.8 CuCO3·Cu(OH)2·H2O
(2)可以 根据反应xCuCO3·yCu(OH)2·zH2O
(x+y)CuO+xCO2↑+(y+z)H2O↑
依据碱式碳酸铜样品、CuO、CO2和H2O质量(或其中任意三个量)即可计算出其组成。
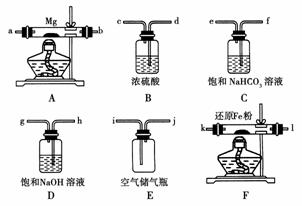
13.(2008年海南)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2
 △,2MgO;②3Mg+N2
△,2MgO;②3Mg+N2
 △,Mg3N2;
△,Mg3N2;
③2Mg+CO2
 △,2MgO+C;④Mg+H2O
△,2MgO+C;④Mg+H2O
 △,MgO+H2↑;
△,MgO+H2↑;
⑤Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)________________________________________________________________________。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?________,原因是_______________________________________________________________________。
(4)请设计一个实验,验证产物是氮化镁:___________________________________。
[解析] 由题目所提供的信息可知:Mg能与O2、CO2、H2O反应,空气中都含有这些气体,所以在Mg与N2反应前先除去以上三种气体,顺序为先除CO2(D装置),再除H2O(B装置),最后除O2(F装置)。在连接装置时,要注意气体流向(长进短出)。Fe与O2反应时应在加热条件(或温度较高)下进行,铁粉没有达到反应温度,不能与O2反应,导致O2除不尽。根据反应⑤可知Mg3N2的水解产物有NH3,可通过测定水解的产物中NH3的存在推出产物是Mg3N2。
[答案] (1)B 目的是除气流中的水蒸气,避免反应④发生;
D 目的是除空气中的CO2,避免反应③发生;
F 目的是除空气中的氧气,避免反应①发生;
(2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)使氮化镁不纯 如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧气同镁反应,而使氮化镁中混入氧化镁
(4)取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成
12.(2008年全国Ⅰ理综)取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水。按下图连接仪器。

实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融物凝固成银白色金属。根据以上叙述回答问题:
(1)元素Z是________;
(2)停止加热前是否需要先断开a和b的连接处?为什么?
________________________________________________________________________;
(3)反应管a中发生的所有反应的化学方程式是_________________________________;
(4)本实验的尾气是否需处理?如需处理。请回答如何处理?如不需处理,请说明理由。________________________________________________________________________
________________________________________________________________________。
[解析] 本题是金属冶炼和实验相结合的综合题。(1)根据澄清石灰水变浑浊,说明a中反应产生了CO2,所以Z元素为氧;(2)由于要冷却还原出的金属,防止其被氧气氧化,所以需要不断通N2,所以也不必断开a、b连接处;(3)要求写出所有的化学方程式,借助信息和中学化学知识,无法推知M是什么元素,所以只要以MO为反应物书写上述4个反应即可;(4)根据4个反应方程式可知尾气中有CO,所以需处理尾气;处理方法可以是燃烧法或通过灼热CuO或用气球直接收集等。
[答案] (1)氧
(2)不需要,因有N2不断通入,b瓶溶液不会倒吸至a管
(3)MO+C
 M+CO↑ MO+CO
M+CO↑ MO+CO

 M+CO2
M+CO2
CO2+C
 △,2CO 2MO+C
△,2CO 2MO+C
 2M+CO2↑
2M+CO2↑
(4)需处理,因含有CO,可连接一个加热的装有CuO粉末的反应管
11.(1)如下图所示A、B、C、D四种仪器;
请选择下列仪器名称的序号,填入相应的空格内:
①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗
⑥酸式滴定管

A______,B______,C______,D______。
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示中可以看出,该同学在操作时的一个错误是____________________,烧杯的实际质量为______g。

(3)指出如下图所示3个实验中各存在的一个错误:

A______________,B______________,C______________。
[解析] (2)使用托盘天平时应将砝码放在右盘,被称量物放在左盘,根据托盘天平的称量原理,左盘质量=右盘质量+游码质量,则烧杯的质量(右盘)=30 g-2.6 g=27.4 g。此时必须注意:标尺的每个小格为0.2 g。
[答案] (1)③ ⑤ ④ ⑥
(2)砝码放在左盘,烧杯放在右盘(或砝码和物品的位置放反了) 27.4
(3)A.滴管口伸入试管中 B.试管口向上 C.混合气体从短导管进入洗气瓶
10.(2007年广东)下述实验能达到预期目的的是
( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
[解析] A项在该反应中,SO2体现还原性;D项两种溶液浓度不同,H2O2分解速率不同,到底是催化剂还是浓度的影响说不清楚。
[答案] BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com