
题目列表(包括答案和解析)
11.(2009年广东单科)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是________________。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是______,现象是__________________。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:__________________;假设2:__________________;假设3:________________________。
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验。按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
… |
|
[解析] (1)根据A中石灰水变浑浊,知有CO2气体,B中有红色固体生成,说明CuO被还原,C中石灰水变浑浊,可知B中CuO被CO还原。
(3)因为题目中说明铁不以三价存在,只能是以二价铁或单质形式,或两者混合物存在。
步骤1:利用K2CO3的溶解性,除去K2CO3;
步骤2:利用铁能置换出Cu,而FeO不能置换出Cu来检验是否含铁单质;
步骤3:利用盐酸酸化分离出FeO,再用H2O2氧化,利用KSCN是否变色,来验证固体中是否含FeO。
[答案] (1)CO2和CO (2)焰色反应 透过蓝色钴玻璃观察到紫色火焰 (3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
③
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体 |
固体产物部分溶解 |
|
步骤2:向试管中加入适量CuSO4溶液,再加入少量上述不溶固体,充分振荡 |
(1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体物质生成,则证明有铁单质存在 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN。 |
结合步骤2中的(2); (1)若溶液基本无色,则假设1成立。 (2)若溶液呈血红色,则假设3成立 |
10.将空气缓慢通过下图所示装置后,在试管中收集到少量气体。空气在通过a-d装置时,依次除去的气体是 ( )

A.O2、N2、H2O、CO2 B.CO2、H2O、O2、N2
C.H2O、CO2、N2、O2 D.N2、O2、CO2、H2O
[解析] 空气依次通过:氢氧化钠溶液(吸收CO2)、浓硫酸(吸收水蒸气)、灼热的过量铜粉(与氧气反应)、灼热的过量镁粉(与N2反应)。
[答案] B
9.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是 ( )

A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
[解析] 解决此类题的关键是分析透彻此实验的反应原理:CuO+H2Cu+H2O,依据反应前后玻璃管的质量差可知生成水中氧元素的质量m(O),U形管的质量差为生成水的质量m(H2O),所以水中氢元素的质量为m(H)=m(H2O)-m(O)。A项因为H2中含有水蒸气,所以m(H2O)的质量偏大,即A可能导致题中结果;B可能吸收空气中的水蒸气即m(H2O)的质量偏大,所以B可能导致题中结果;C选项相当于Ⅱ装置中玻璃管的质量反应后增加了玻璃管内冷凝的水中氢的质量,使m(O)减小,导致误差偏高;D对实验结果无影响。
[答案] D
8.为了检验某无色溶液中是否有SO存在,三位同学分别提出了自己的实验方案。
方案①:试液中加入氯化钡溶液→有白色沉淀→加入足量盐酸,沉淀不消失
方案②:试液中加入稀硝酸溶液,无沉淀→加入硝酸钡溶液→有白色沉淀
方案③:试液中加入足量盐酸,无沉淀→加入氯化钡溶液→有白色沉淀
上述方案中能确认有SO存在的是 ( )
A.只有① B.只有②
C.只有③ D.①②③都可以
[解析] 方案①:试液中加入氯化钡溶液,产生的白色沉淀可能是BaSO4、BaCO3、BaSO3和AgCl等,加入盐酸后,BaCO3、BaSO3可溶解,BaSO4和AgCl不溶解,因此原溶液中可能含有Ag+或SO,该方案不能证明是否含有SO。
方案②:试液中加入稀硝酸溶液,由于硝酸有强氧化性,若溶液中含有SO,将被氧化成SO,因此原溶液中可能含有SO或SO或它们的混合物,该方案也不能证明是否含有SO。
方案③:试液中加入足量盐酸无沉淀,说明原溶液中不含Ag+,再加入氯化钡溶液,由于BaSO3、BaCO3在酸性条件下均不能生成,因此白色沉淀一定是BaSO4。
[答案] C
7.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH、Fe2+、SO和 H2O,下列实验叙述中不正确的是 ( )
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO
D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH
[解析] D项中检验NH时,加入NaOH溶液,加热,能产生NH3,NH3可使试管口湿润的红色石蕊试纸变蓝色,因为氨气遇水能生成显碱性的NH3·H2O。故D不正确。
[答案] D
6.(2007年上海)可用下图所示装置制取(必要时可加热)、净化、收集的气体是( )

A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
[解析] A项NO气体不能用排空气法收集;C项H2的收集应使用向下排空气集气法;D项H2S气体不可以用浓硫酸干燥,因为两者会发生氧化还原反应。
[答案] B
5.右图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是 ( )
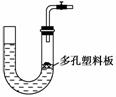 A.大理石和稀硫酸制取二氧化碳
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和水制取乙炔
[解析] A项不能用H2SO4与CaCO3反应制CO2,应用HCl。因CaSO4微溶于水。C项MnO2与浓HCl反应制Cl2需加热。D项电石与水的反应过于剧烈,且反应放热。
[答案] B
4.实验室制取1氯丙烷(沸点46.6 ℃)正确的操作顺序是 ( )
①向蒸馏烧瓶中加入固体氯化钠,再加入1丙醇及浓硫酸混合液,塞好带温度计的木塞 ②将蒸馏烧瓶固定在铁架台上,塞好带温度计的木塞 ③把酒精灯放在铁架台上,根据酒精灯的火焰确定铁圈的高度,固定铁圈,放上石棉网 ④检查装置的气密性 ⑤加热 ⑥通入冷却水
A.④③②①⑤⑥ B.③②④①⑥⑤
C.④③②①⑥⑤ D.③④②①⑤⑥
[解析] 从实验仪器的安装原则去考虑,从下向上,从左到右。
[答案] B
3.某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是
( )
A.Cl2FeCl3FeCl3溶液
B.Cl2HCl盐酸FeCl2溶液FeCl3溶液
C.Cl2HCl盐酸FeCl2溶液FeCl3溶液
D.―→FeCl3溶液
[答案] B
2. (2009年上海单科)1丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125 ℃,反应装置如右图。下列对该实验的描述错误的是 ( )
(2009年上海单科)1丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125 ℃,反应装置如右图。下列对该实验的描述错误的是 ( )
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1丁醇的转化率
[解析] A项,该反应温度为115-125 ℃,超过了100 ℃,故不能用水浴加热。B项,长玻璃管利用空气进行冷凝回流。C项,提纯乙酸丁酯不能用NaOH溶液洗涤,酯在碱性条件下会发生水解反应。D项,增大乙酸的量可提高醇的转化率。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com