
题目列表(包括答案和解析)
8.某气态化合物X含C、H、O三种元素,现已知下列条件,欲确定化合物X的分子式,所需的最少条件是 ( )
①X中C的质量分数 ②X中H的质量分数 ③X在标准状况下的体积 ④X对氢气的相对密度 ⑤X的质量
A.①②④ B.②③④
C.①③⑤ D.①②
[解析] 确定X的化学式应知道X的相对分子质量,条件④可以求X的相对分子质量;确定X分子中C、H、O的原子个数时,至少应已知X中两种元素的质量分数,①和②能满足要求。所以最少的条件组合为①②④。
[答案] A
7.茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:

关于茉莉醛的下列叙述错误的是 ( )
A.在加热和催化剂作用下,能被氢气还原
B.能被高锰酸钾酸性溶液氧化
C.在一定条件下能与溴发生取代反应
D.不能与氢溴酸发生加成反应
[解析] 茉莉醛中含有-CHO和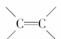
 两种官能团,含有
两种官能团,含有 和-CH2(CH2)3CH3两种烃基,因此能发生取代、还原、氧化、加成反应,与氢溴酸在一定条件下可加成。
和-CH2(CH2)3CH3两种烃基,因此能发生取代、还原、氧化、加成反应,与氢溴酸在一定条件下可加成。
[答案] D
6.某3 g醛和足量的银氨溶液反应,结果析出43.2 g Ag,则该醛为 ( )
A.甲醛 B.乙醛
C.丙醛 D.丁醛
[解析] 因1 mol一元醛通常可以还原得到2 mol Ag,现得到0.4 mol Ag,故醛为0.2 mol,该醛的摩尔质量为=15 g/mol,此题似乎无解,但1 mol甲醛可以得到4 mol Ag,即3 g甲醛可得到43.2 g (0.4 mol)Ag,符合题意。
[答案] A
5.有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1 mol乙跟足量的金属钠反应放出标准状况下的氢气22.4 L,据此推理乙一定不是 ( )
[解析] 1
mol乙能跟Na反应放出1
mol H2,证明乙为二元醇,则D物质不是;甲能发生银镜反应,证明有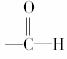 ,则加氢反应后,生成的醇羟基应在链端,故C也不是。
,则加氢反应后,生成的醇羟基应在链端,故C也不是。
[答案] CD
4.绿色化学是当今社会提出的一个新概念,在“绿色化学工艺”中,理想状态是反应物中原子全部转化为欲制得的产物,即原子利用率为100%,在用 合成
合成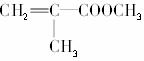 的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
A.CO和CH3OH B.CO2和H2O
C.H2和CO D.CH3OH和H2
[解析] 根据题干提供信息的要求,要使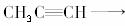
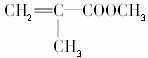 ,原子利用率达到100%,由C3H4―→C5H8O2,需C2H4O2即可。答案A中CO和CH3OH按1∶1即可,答案C中H2和CO按2∶2即可,B与D组合不成。
,原子利用率达到100%,由C3H4―→C5H8O2,需C2H4O2即可。答案A中CO和CH3OH按1∶1即可,答案C中H2和CO按2∶2即可,B与D组合不成。
[答案] AC
3.在实验室里不宜长期放置,应在使用时配制的溶液是 ( )
①酚酞试剂 ②银氨溶液 ③Na2CO3溶液 ④氢氧化铜悬浊液 ⑤酸化的FeCl3溶液 ⑥硫化氢水溶液
A.只有②④ B.除①之外
C.只有②④⑥ D.全部
[解析] 银氨溶液不能长期放置,生成易爆物质,Cu(OH)2长期放置易板结,H2S易被氧化。
[答案] C
2.(2008年江苏)香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
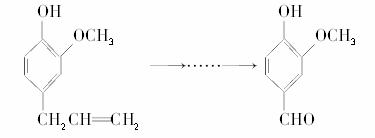
丁香酚 香兰素
有关上述两种化合物的说法正确的是 ( )
A.常温下,1 mol丁香酚只能与1 mol Br2反应
B.丁香酚不能与FeCl3溶液发生显色反应
C.1 mol香兰素最多能与3 mol氢气发生加成反应
D.香兰素分子中至少有12个原子共平面
[解析] A项既可发生加成反应,又可发生取代;B项有酚羟基能发生显色反应;C项中的苯环和醛基都能发生加成反应,故应消耗4 mol H2;D项可由苯环共面迁移得出答案。
[答案] D
1.(2009年浙江理综)一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为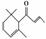 :有关该化合物的下列说法不正确的是 ( )
:有关该化合物的下列说法不正确的是 ( )
A.分子式为C13H20O
B.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2
D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
[解析] A项正确;B项,结构中含有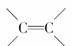 CC,可以发生聚合反应;C项,根据含氧衍生物燃烧通式即O2可计算应消耗17.5
mol O2;D项,αdamascone与Br2反应生成卤代烃,水解得醇与HBr,硝酸酸化后可用AgNO3检验Br-。
CC,可以发生聚合反应;C项,根据含氧衍生物燃烧通式即O2可计算应消耗17.5
mol O2;D项,αdamascone与Br2反应生成卤代烃,水解得醇与HBr,硝酸酸化后可用AgNO3检验Br-。
[答案] C
13.(2007年上海)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
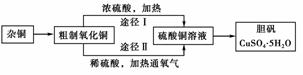
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 ( )
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,称量操作至少进行________次。
(6)若测定结果x值偏高,可能的原因是 ( )
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
[解析] (1)问如果坩埚中的物质冷却时能吸水或易被氧化,则放入干燥器中冷却,如果没有这些要求则放到石棉网上,防止烫坏实验台。
(2)问杂铜中含有大量有机物,如果燃烧不完全则产生具有还原性的物质碳或一氧化碳,在灼烧的过程中可能还原CuO,所以选a。选项b很容易选出。
(3)问要搞清楚题干中过滤的目的,过滤是要滤掉粗制的CuO中不溶于H2SO4的物质,那么后面的两个空不难做答。
(4)问因为粗制的CuO中含有Cu,在加热时与浓H2SO4反应产生SO2,既污染环境,又浪费H2SO4。
(6)问加热温度过高CuSO4分解使x值偏高。颗粒较大分解不完全,放在空气中冷却又吸收水,部分风化已失去部分结晶水,这些因素都造成x值偏低。
[答案] (1)c e b (2)ab (3)蒸发 过滤
(4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气的气体 (5)4 (6)a
12.(2009年上海单科)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
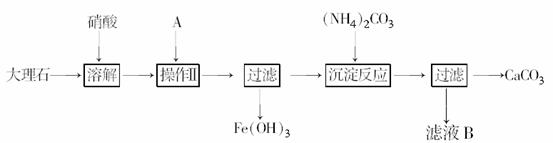 (1)溶解大理石时,用硝酸而不用硫酸的原因是______________________
(1)溶解大理石时,用硝酸而不用硫酸的原因是______________________
(2)操作Ⅱ的目的是______________,溶液A(溶质是共价化合物)是________________。
(3)写出检验滤液中是否含铁离子的方法: ____________________________________。
(4)写出加入碳酸铵所发生反应的离子方程式:
___________。
写出滤液B的一种用途:________________________________________________________________________。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞
仪器:电子天平、锥形瓶、滴定管
实验步骤:
①__________;②加入__________________;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为______________。
[解析] (1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生。
(2)溶液A应呈碱性且溶质为共价化合物,故溶液A是氨水,目的是除去Fe3+。
(3)Fe3+能与KSCN溶液反应生成红色的Fe(SCN)3,用此原理来检验Fe3+的存在。
(4)滤液B的主要成分是NH4NO3,可用于制造化肥。
(5)首先称量固体的质量,再加入过量的盐酸标准溶液,过量的盐酸再用NaOH标准溶液滴定。
(6)半滴溶液的体积为×= mL,则相对误差为×100%=0.1%。
[答案] (1)硫酸钙微溶于水
(2)除去溶液中Fe3+ 氨水(合理即可)
(3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
(4)Ca2++CO===CaCO3↓ 作化肥(合理即可)
(5)称量 过量的标准盐酸 (6)0.1%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com