
题目列表(包括答案和解析)
14.短周期元素X、Y、Z中,X与Y的原子核外电子层数相同,X的原子半径大于Y,Xm+与Zn+具有相同的电子层结构。下列叙述一定正确的是
( )
A.Y是非金属元素
B.若m>n,则Xm+的半径大于Zn+的半径
C.X、Y、Z三种元素位于元素周期表中的不同周期
D.若X、Y形成化合物的电子式是X+[······ ··]-,则原子序数Y>Z>X
[解析] A项,Y也有可能是金属;B项,若m>n,则Xm+的半径小于Zn+的半径;C项,三者在同周期;D项X+为+1价,说明n>1,则Z的原子序数应比X大。
[答案] D
13.(2009年江苏单科)X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
[解析] 根据题意推出:X为H、Y为O、Z为Na、W为Al、R为S。A项,O2-、Na+、Al3+具有相同的电子层结构,原子序数越小,半径越大,应为r(O2-)>r(Na+)>r(Al3+);B项,X与Y可形成化合物H2O2;C项,O的非金属性大于S,说明H2O的热稳定性大于H2S;D项,Al(OH)3是两性氢氧化物,不是强酸。
[答案] C
12.有四种晶体,其离子排列方式如图所示,其中化学式不属AB型的是
( )
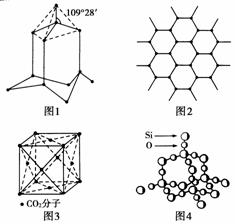
[解析] 用均摊法知A、B、D化学式均为AB型,而C的化学式:A∶B=8×∶12×=1∶3。
[答案] C
11.实现下列变化时,需克服相同类型作用力的是
( )
A.水晶和干冰的熔化 B.食盐和醋酸钠的熔化
C.液溴和液汞的汽化 D.HCl和NaCl溶于水
[解析] 应判断晶体类型是否相同,只有晶体类型相同,发生状态改变时,克服的作用力类型才相同。对D项,HCl溶于水破坏的是共价键,NaCl溶于水破坏的是离子键。
[答案] B
10.下列说法中错误的是
( )
A.非金属单质只能形成分子晶体
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.CO2与SiO2晶体熔化时,所克服的微粒间相互作用不相同
D.短周期元素离子aXm- 和bYn-具有相同的电子层结构,若a>b,则n>m
[解析] 如金刚石、晶体硅均属于原子晶体。
[答案] A
9.有关晶体的下列说法中正确的是
( )
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
[解析] 晶体中分子间作用力越大,其熔、沸点越高;分子内化学键的键能越大,分子越稳定,A错。原子晶体中共价键越强其熔点越高,B对。冰熔化时分子间作用力受到破坏,水分子中共价键未发生断裂,C错。氯化钠晶体熔化时离子键被破坏,D错。
[答案] B
8.下列物质呈固态时必定是分子晶体的是
( )
A.非金属氧化物 B.非金属单质
C.金属氧化物 D.含氧酸
[解析] 此题必须对物质分类与晶体类型关系清楚,如,SiO2是原子晶体,而CO2是分子晶体等。
[答案] D
7.(2007年天津理综)下列关于粒子结构的描述不正确的是
( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2Cl2和CCl4均是四面体构型的非极性分子
D.1 mol DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
[解析] A项,H2S和NH3都是价电子总数为8的极性分子。B项,HS-和HCl都只含一个极性键,都具有18个电子。C项,CH2Cl2是极性分子。D项,一个氘原子中含有一个质子、一个电子、一个中子。
[答案] C
6.(2007年上海)请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
( )
A.几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B.用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C.一定条件下,金属钠可以成为绝缘体
D.一定条件下,水在20 °C时能凝固成固体
[解析] 根据质量守恒定律可知A项说法成立;B项中改变原子中核外电子可通过化学反应来实现,而改变原子核构成需通过核聚变或核裂变来实现,由此可见斧头劈木块时,是不存在上述两种过程的。C项在一定条件下,使金属钠以气态原子形式存在,此时缺少自由电子的钠可成为绝缘体。D项水的凝固点会随压强增大而升高。
[答案] B
5.(2008年上海综合能力)人们常用干冰营造云雾缭绕的舞台效果,这是因为干冰在室温下容易直接变成气体。在此过程中体积可以增大很多倍,原因是 ( )
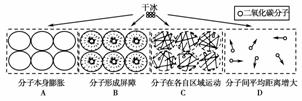
[解析] 物质三态间的变化是物理变化,分子本身不变,分子之间的距离发生变化。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com