
题目列表(包括答案和解析)
3.下列结论正确的是
( )
①微粒半径:S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Te ③离子还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te ⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se
A.②④⑥ B.①③④
C.只有① D.⑥
[答案] A
2.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同。以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
( )
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温下灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温下灼烧,区别残留固体的颜色
[解析] CuS、Cu2S灼烧后的产物都是CuO和SO2,等质量的CuS和Cu2S在高温下灼烧后的残留物质量不同,以此可将二者区别开来,残留物重的是Cu2S。
[答案] C
1.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
( )
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HCHO溶液(石蕊试液)
[答案] A
21.(10分)下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
|
10电子粒子 |
CH4、NH3、H2O、HF、Na+、Al3+、NH、F- |
|
18电子粒子 |
H2S、HCl、K+、S2-、HS-、Cl- |
(1)其中空间构型为正四面体的分子的是________;受热最难分解的分子是________。
(2)其中能与OH-反应的分子有______________________;既能与H+反应又能与OH-反应的粒子有________。
(3)其中在水溶液中能够促进水电离的粒子有__________________________;写出一种由表中粒子组成的离子化合物水溶液呈酸性的离子方程式 _______________________
________________________________________________________________________。
(4)由第二周期元素形成的氢化物A和B都含有18电子,A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16 g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式________________________________________________________________________
________________________________________________________________________。
[解析] 对10e-、18e-微粒进行了全面的考查。
[答案] (1)CH4 HF (2)HF、H2S、HCl HS-
(3)Al3+、NH、F-、S2-、HS- NH+H2ONH3·H2O+H+
(4)N2H4(l)+2H2O2(l)===4H2O(l)+N2(g);ΔH=-1 676 kJ·mol-1
20.(11分)原子序数从小到大排列的四种短周期元素W、X、Y、Z,四种元素的原子最外层电子数之和等于12;W是原子半径最小的元素;由X、Y元素可组成非极性分子A,A在常温下为气体;由Y、Z元素按原子个数比1∶1可组成离子化合物B;A与B反应可生成Y2气体。
(1)元素W是:________;写出B的电子式_________________________________。
(2)写出金属镁在A中燃烧的化学方程式:________________________________,该反应属于________(填写序号)。
a.置换反应 b.化合反应 c.分解反应
d.复分解反应 e.氧化还原反应
(3)C是由X、Y、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是________。
(4)D是由W、X、Y三种元素按原子个数比为1∶1∶2组成的一种酸,D在常温下为固体。已知在含1 mol D的水溶液中加入1 mol C恰好反应生成1 mol A。则D的化学式是________;D能使酸性高锰酸钾溶液褪色,说明D具有________性。
[解析] W是原子半径最小的元素,则W为H元素;B和A反应生成Y2,可推出B为Na2O2,A为CO2。
[答案] (1)H Na+[······ ······ ··]2-Na+
(2)2Mg+CO22MgO+C ae
(3)Na2CO3 (4)H2C2O4 还原
19.(8分)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒。
A:________;B:________;C:________;D:________。
(2)写出A、B、E三种微粒反应的离子方程式:
________________________________________________________________________。
[答案] (1)H2O NH3 NH OH-
(2)Al3++3NH3+3H2O===Al(OH)3↓+3NH
Mg2++2NH3+2H2O===Mg(OH)2↓+2NH
18.(12分)A、B、C、D、E为元素周期表中前三周期形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8。
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C离子的结构示意图为____________,该反应的离子方程式为___________________________________________________________。
(2)任何水溶液中都有A、D两种离子,D离子的电子式是____________。
(3)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁跟丙反应产生无色无味的气体,该反应的化学方程式为__________________________________。
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和甲的水溶液可形成氢氧燃料电池,负极的电极反应为______________________,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为________。
(5)有一种液态氮氢化合物戊,与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,戊的电子式为______________,8 g该液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375 kJ的热量,写出该反应的热化学方程式_____________________________________________
________________________________________________________________________。
[解析] 由(2)知A、D为OH-、H3O+,再结合(1)综合分析可知A为OH-,B为Na+,C为Al3+;(3)含钠离子的化合物与H2O反应生成无色无味气体,该化合物应为Na2O2,所以E为O。

17.(11分)(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4
⑦CO2 ⑧NaF ⑨NH3 ⑩I2,其中由非极性键形成的非极性分子是________;由极性键形成的非极性分子是________;既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:__________________;若XY2为共价化合物时,其结构式为:________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是______________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是__________________________________________。
(4)现有a-g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
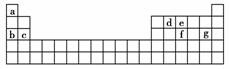
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是________。
A.c和f B.b和g
C.d和g D.b和e
②写出a-g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式__________。
[解析] (2)1∶2型离子化合物,通常X为+2价,Y为-1价,故X可能是Mg2+或Ca2+,Y可能是F-或Cl-,结合XY2中含有38个电子条件可推出XY2为CaF2,1∶2型共价化合物则为CS2。
[答案] (1)①②⑩ ⑥⑦ ④ ③⑤

(3)共价化合物 氯化铝在熔融状态下不能导电
(4)①B C ②CCl4或PCl3
16.X、Y、Z、W四种元素在周期表中相对位置如下图,Y、Z质子数之和为21,下列说法正确的是 ( )

A.常压下,四种元素单质中,W单质的熔点最高
B.Z的阳离子与Y的阴离子电子层结构相同
C.X的气态氢化物比Y的气态氢化物稳定
D.W元素的金属性比Z元素金属性强
[解析] 根据Y、Z的质子数之和为21,推出Y为氧元素,Z为铝元素,进一步可推出X为碳元素,W为磷元素。
[答案] B
第Ⅱ卷 (非选择题,52分)
15.人们研究金星大气成分,发现金星大气中有一种称之为硫化羰(COS)的分子,其结构与CO2类似,硫化羰是一种与生命密切相关的物质,下列有关COS的推测肯定不正确的是
( )
A.COS分子是含有极性键的极性分子
B.COS属于离子化合物
C.COS的结构式为SCO
D.COS分子中所有原子都满足8电子稳定结构
[解析] COS分子中不存在离子键,它是共价化合物。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com