
题目列表(包括答案和解析)
5.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示装置)。下列有关说法正确的是
( )
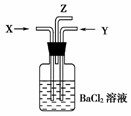
A.气瓶中产生的沉淀是碳酸钡
B.Z导管出来的气体中无二氧化碳
C.气瓶中产生的沉淀是硫酸钡
D.Z导管口有红棕色气体出现
[解析] 碳与浓硫酸共热的反应为:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,气体X是CO2和SO2的混合气体,铜与浓硝酸的反应为:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,气体Y是NO2气体,将气体通入BaCl2溶液中,由于NO2与水反应生成HNO3,同时产生NO气体,NO与O2在Z管口处生成红棕色NO2气体,故D选项正确。而HNO3的强氧化性可将H2SO3氧化成H2SO4,所以洗气瓶中生成的沉淀是BaSO4,CO2与BaCl2不能产生沉淀,故CO2气体从Z管口逸出。
[答案] CD
4.利用废铜屑制取CuSO4溶液最好的方法是
( )
A.铜屑和浓硫酸混合加热
B.铜屑在空气中燃烧后再溶于稀H2SO4
C.铜屑与稀硫酸混合加热
D.铜屑在空气中灼热后再溶于浓H2SO4
[解析] 制取CuSO4的两种反应原理分别为:①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;②2Cu+O22CuO,CuO+H2SO4===CuSO4+H2O。生成等质量的CuSO4,第一种方法消耗的硫酸多一倍,且产生了能污染空气的SO2气体。第二种方法中用稀硫酸溶解CuO比用浓H2SO4时更易操作。
[答案] B
3.飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中的SO2接触时,SO2会部分转化为SO3,使其污染更严重。飘尘所起的作用是
( )
A.氧化剂 B.还原剂
C.催化剂 D.载体
[解析] 该过程可表示为2SO2+O2 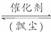 2SO3。
2SO3。
[答案] C
2.化工厂厂址选择是一个复杂的问题,受到原料、水源、能源、土地供应、市场需求、交通运输和环境保护等诸多因素的制约,硫酸厂应建在
( )
①靠近原料产地,远离消费中心的地区 ②靠近消费中心,稍偏离原料产地的地区 ③交通便利,人口稠密的居民区 ④环保要求高的地区,便于“三废”的治理
A.①②③④ B.①③④
C.①②④ D.②
[解析] 因硫酸是一种强腐蚀性液体,运输极不方便,需要较高的成本,所以硫酸工厂厂址选择上首先要考虑建在②且远离环保要求高的地区。
[答案] D
1.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因,二者都正确的是
( )
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
D.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全
[解析] 选项A中操作正确,但说明不对,将矿石粉碎是使矿石与空气的接触面积增大,可以燃烧得更充分、更快。B项的说明不对,净化的目的是防止炉气中的杂质和矿尘使催化剂中毒、失效。选项C的说明是错误的,催化剂的作用是缩短反应完成的时间。选项D正确。
[答案] D
14.SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下图所示实验装置:
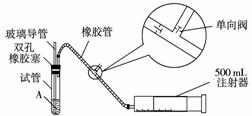
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后________________(填写操作方法)时,将会看到________________________________________________________________________。
(填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.000 5 mol·L-1的碘水1.0 mL,用适量的蒸馏水稀释后再加入2-3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由________色变为________色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为__________________________。
(3)我国环境空气质量标准中对每次空气SO2的最高深度限值如下表:
|
浓度限值/mg·m-3 |
||
|
一级标准 |
二级标准 |
三级标准 |
|
0.15 |
0.50 |
0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气次数如下(假设每次抽气500 mL)。请将下表填写完整(计算时保留2位有效数字):
|
分组 |
第一小组 |
第二小组 |
|
抽气次数 |
120 |
140 |
|
SO2含量/mg·m-3 |
|
|
判断该地点的空气中SO2的含量属于________(填数字)级标准,________(“第一”或“第二”)小组的测定结果正确。另一小组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)___________________________________________________________
________________________________________________________________________。
[答案] (1)向外轻拉动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出 (2)蓝 无 SO2+I2+2H2O===H2SO4+2HI
(3)第一小组:0.53 第二小组:0.46 三 第一 抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大误差
13.SO2是一种无色有刺激性气味的有毒气体,它是一种大气污染物,SO2的职业性慢性中毒会引起丧失食欲、大便不通和气管炎等症状,在空气中SO2的含量不得超过0.02 mg·L-1。其分子结构如图所示,呈“V”形,键角为120°,三个原子以S原子为中心与两个O原子分别构成一个极性键,中间S原子提供2个电子,两个O各提供1个电子,构成一个特殊的化学键(虚线内部分,三个原子均等的享有这4个电子)。
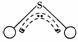
请回答:
(1)SO2分子是否有极性________(填“是”或“否”)。
(2)分子中某一个原子有一对没有跟其他原子共用的电子叫做孤对电子,那么SO2分子有________对孤对电子。
(3)由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,这样的粒子可互称为等电子体,它们具有相似的结构特征,由短周期元素组成的粒子中写出一种与SO2互为等电子体的粒子________。
(4)SO2在一定条件下与O2反应可转变为SO3,方程式为:
________________________________________________________________________。
生成的SO3的其结构与下列分子结构最相似的是( )
A.NH3 B.BF3
C.PCl3 D.P4
(5)Cl2和SO2都有漂白性,当将两者等体积通入溶液时,都会失去漂白作用,写出有关的离子方程式:______________________________________,某品红溶液褪色后如何判断是Cl2漂白还是SO2漂白_________________________________________________________。
[解析] 根据SO2的分子结构和成键情况可知SO2为极性分子,且分子中有5对孤对电子;由等电子体的概念可知O3或NO与SO2互为等电子体;由SO3最外层电子数之和为24,只有BF3的最外层电子数之和也为24,且分子中的原子数相等,二者互为等电子体,分子结构相似。Cl2和SO2等体积混合后发生Cl2+SO2+2H2O===2HCl+H2SO4反应,失去漂白作用。根据SO2和Cl2漂白作用的特点可用加热的方法区别,加热后恢复红色的为SO2漂白;反之为Cl2。
[答案] (1)是 (2)5 (3)O3或NO
(4)2SO2+O2  2SO3 B
2SO3 B
(5)Cl2+SO2+2H2O===4H++2Cl-+SO
将漂白后的溶液加热,能恢复红色的为SO2漂白;否则为Cl2漂白
12.酸雨是天空降水呈酸性(pH小于5.6)的统称,个别地方竟低于2.1(食醋的pH=3)。形成酸雨的原因是大气中的SO2和氮氧化物。主要来源是煤和石油的燃烧,全世界每年有1.5亿吨SO2的排放量。
(1)SO2可在空气中受光照被氧化,最终与雨水形成酸雨。试写出这两个化学反应方程式:________________________________________________________________________
________________________________________________________________________。
酸雨在放置中,测定其pH逐渐减小,发生反应的方程式为:
________________________________________________________________________。
(2)汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物,全世界每年排放量约5×107 kg。NO2溶于水生成________酸。
(3)酸雨可导致的危害有________。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
(4)为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行________,对废气中的氮氧化物进行________。
[解析] (1)SO2受光照被氧化为SO3,SO3进而形成H2SO4。
(2)3NO2+H2O===2HNO3+NO。
(3)酸雨造成的危害很大,如腐蚀建筑物;使树木枯萎;使环境恶化等。
(4)在燃料中加入石灰石,使其分解生成的CaO和SO2反应,使其不放入空气中,对氮的氧化物应用碱液吸收。
[答案] (1)2SO2+O22SO3,SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
(2)硝 (3)ABD (4)脱硫 碱液吸收
11.两位同学设计下述两种实验方案,并都认为,如果观察到的现象与自己的设计方案一致,即可确认为无色气体中一定含有SO2和CO2气体。
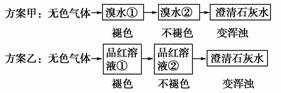
请你评价上述两个方案是否严密并说明理由:
方案甲:____________________________________________________________;
方案乙:_____________________________________________________________
________________________________________________________________________。
[答案] 不严密,并非只有SO2才能使溴水褪色
严密,品红溶液①褪色证明有SO2,品红溶液
②不褪色,且澄清石灰水变浑浊证明有CO2
10.在标准状况下,4.48 L SO2、CO2、H2的混合气体通入适量的饱和NaHCO3溶液中,充分反应后,若溶液中只有NaHSO3,逸出的气体中只有CO2和H2,且其质量之和为4.60 g,则混合气体中SO2、CO2和H2的体积比可能为
( )
A.1∶1∶1 B.1∶1∶2
C.1∶2∶2 D.1∶2∶3
[解析] 涉及的反应为:SO2+NaHCO3===NaHSO3+CO2,SO2转化为CO2且物质的量不变。反应后H2和CO2的总物质的量为0.2 mol。H2和CO2混合气体的平均摩尔质量为=23 g·mol-1,利用十字交叉法:
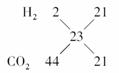
即n(CO2)∶n(H2)=1∶1,由于SO2转化为CO2时的关系为1∶1,所以有n(CO2)+n(SO2)=n(H2)。
[答案] BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com