
题目列表(包括答案和解析)
21.(10分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.100 0 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020 00 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
已知:SO2+2Fe3++2H2O===SO+2Fe2++4H+
Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式
________________________________________________________________________。
(3)煅烧10 t 上述黄铁矿,理论上产生SO2的体积(标准状况)为________L,制得98%的硫酸质量为________t,SO2全部转化为H2SO4时放出的热量是________kJ。
[解析] (1)据元素守恒及物质反应时物质的量关系可得
3FeS2-6SO2-12Fe2+-2Cr2O
3 2
n(FeS2) 0.020 00 mol·L-1×25.00 mL×10-3L·mL-1
=
m(FeS2)=0.09 g, 所以 w(FeS2)=×100%=90.00%
(2)根据元素守恒关系知
n(SO2)=n(S)=×2
=×2=0.1 mol
所以1 mol SO3与水化合生成H2SO4放出130.3 kJ热量。
(3)据元素守恒可得
n(SO2)==1.5×105mol
则V(SO2)=1.5×105 mol×22.4 L·mol-1=3.36×106L
制得98%的硫酸质量为=
=
=15×106 g=15 t。
根据盖斯定律并由(2)中信息可知,0.1 mol SO2全部转化为H2SO4放出的热量是13.03 kJ+9.83 kJ=22.86 kJ,则1.5×105 mol SO2应放出的热量是10×1.5×105×22.86 kJ =3.43×107 kJ。
[答案] (1)90.00%
(2)SO3(g)+H2O(l)===H2SO4(l);ΔH=-130.3 kJ·mol-1
(3)3.36×106 15 3.43×107
20.(10分)有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是________________________________________________________________________,
此液体具有的性质是________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为____________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是__________________________________________
________________________________________________________________________。
[解析] 由“ZY3溶液遇苯酚呈紫色”知Z为Fe, 由“X单质在空气中燃烧生成一种无色有刺激性气味的气体,该气体能被O2氧化”知X为S,而S2-与Y-含有相同的电子数,故Y为Cl。(1)Cl最高化合价为+7价。(2)FeCl3滴入沸水得红褐色液体为Fe(OH)3胶体,应具有胶体性质,故a、b项正确。加热,胶体聚沉,HCl挥发,促使FeCl3完全水解得到Fe(OH)3沉淀,灼烧得到Fe2O3,故d项也正确。
(3)①2SO2+O2
 2SO3;ΔH=-196
kJ·mol-1
2SO3;ΔH=-196
kJ·mol-1
2 mol 196 kJ
x 176.4 kJ
x=1.8 mol
SO2转化率为×100%=90%
②Y的含氧酸为HClO3,具有强氧化性。SO2具有还原性,在水溶液中被氧化为H2SO4,HClO3被还原为氧化物。1.5 mol HClO3转移1.5 mol电子,即降一个价态变为,氯的氧化物为ClO2。该小问是应用氧化还原反应化合价升降原理或电子守恒原理推导氧化还原反应化学方程式。
[答案] (1)HClO4
(2)Fe3++3H2OFe(OH)3(胶体)+3H+ abd
(3)①90% ②SO2+2HClO3===H2SO4+2ClO2
19.(10分)如图所示是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。

请按要求填空:
(1)反应③的化学方程式________________________________________________。
(2)C的结构式____________;H的化学式__________。
(3)L的溶液与化合物E反应的离子方程式_____________________________________
________________________________________________________________________。
(4)化合物J的化学式________________。
[解析] 突破口在于C、D常温常压下为气态的非金属单质,反应②是化工生产中重要的反应,符合这两个条件的是H2和Cl2,N2和H2,K为常用的氮肥,则F为NH3;E为造成酸雨的污染物,可由常温常压下非气体的非金属A和B气体制得,故为SO2,H即为NH4HSO3或(NH4)2SO3。由Cl2与NaOH制得的漂白性物质L为NaClO,它与NH3反应生成J,J又可与O2生成C等信息,可知构成J化合物的元素是N和H,式量为32的必为N2H4,则C为N2。根据氧化还原的原理可写出方程式。A为S,B为O2,C为N2,D为H2,E为SO2,F为NH3,L为NaClO,H为NH4HSO3或(NH4)2SO3,I为NaCl,J为N2H4,K为(NH4)2SO4。
[答案] (1)2NH3+H2SO4===(NH4)2SO4
(2)NN (NH4)2SO3或NH4HSO3
(3)ClO-+SO2+2OH-===Cl-+SO+H2O
(4)N2H4
18.(12分)某校活动小组用图所示装置及所给药品(下图所示中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。

请回答下列问题:
(1)已知0.5 mol SO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)检查完装置的气密性,加入药品开始实验,此时首先应进行的操作是________________________________________________________________________。
(3)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是______________________________;装置C中浓硫酸的作用为__________;装置D中盛放的溶液是足量的________(选填字母)。
a.BaCl2溶液 b.NaOH溶液 c.NaHSO3饱和溶液
(4)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是________________________________________________________________________。
(5)实验结束,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则此条件下二氧化硫的转化率是________________(用含字母的代数式表示,结果可不化简)。
[解析] (2)要使SO2和O2反应,则应先加热催化剂。
(3)SO2与O2正好反应的体积比为2∶1,现为1∶1,显然是增大了O2的浓度,目的是提高SO2的转化率。联系工业生产,浓H2SO4是用来吸收SO3的,装置D是用来吸收未反应的SO2,故用NaOH溶液。(5)计算SO2的转化率,C中生成n(BaSO4)=mol,减去原浓硫酸生成的BaSO4沉淀,则由SO3生成的BaSO4沉淀的物质的量即SO3的物质的量为mol,由D的增重可算出未反应的SO2的物质的量为mol,根据转化率的定义即可计算。
[答案] (1)SO2(g)+O2(g)SO3(g);ΔH=-98.3 kJ·mol-1
(2)给催化剂加热 (3)增大氧气的浓度,提高二氧化硫的转化率 吸收SO3 b
(4)继续通入氧气一段时间 (5)×100%
17.(10分)校办厂漂白车间需22.4 L(标准状况)SO2。化学研究小组同学依据化学方程式Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/cm3)110 mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回。
(1)化学小组所制得的气体中混有的主要杂质气体可能是________(填分子式)。产生这种结果的主要原因是_____________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)为证实相关分析,化学小组的同学设计了如下图所示实验装置,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收)。
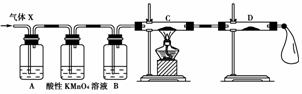
①组装好仪器后,盛放药品前,必要的一个操作是_____________________________
____________________________。
②A中加入的试剂可能是______________________________,作用是________________________________________________________________________。
B中加入的试剂可能是________,作用是____________________________________。
③可证实气体X中混有较多量某杂质气体的实验现象是:
C中:______________________,D中:_________________________________。
[解析] 有关气体性质的实验室反应,均需在装药品前,检查装置的气密性。利用SO2、氢气的性质,不难找出A、B的试剂,C、D的实验现象。
[答案] (1)H2 随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2 (2)①检查装置的气密性 ②品红试液 确认SO2存在 浓H2SO4 干燥氢气 ③黑色CuO粉末变红色 无水硫酸铜变蓝色
16.将a mol硫化亚铁放入含3a mol H2SO4的浓硫酸中,充分反应后,氧化、还原产物分别是Fe3+和S、SO2,则:①硫化亚铁全部溶解;②放出1.5a mol气体;③硫化亚铁部分溶解;④放出的气体少于1.5a mol;⑤无法确定。上述叙述正确的是
( )
A.① B.②③
C.①④ D.⑤
[解析] 假设不考虑浓H2SO4不变稀时有,2FeS+6H2SO4===Fe2(SO4)3+2S↓+3SO2↑+6H2O;浓硫酸变稀时有,FeS+H2SO4===H2S↑+FeSO4,放出的气体肯定小于1.5a mol。
[答案] C
第Ⅱ卷 (非选择题,52分)
15.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
( )
A.温室效应--二氧化碳
B.光化学污染--二氧化氮
C.酸雨--二氧化碳
D.臭氧层破坏--氟氯烃
[解析] NOx与SO2是形成酸雨的主要物质。
[答案] C
14.下列事实能用同一原理解释的是
( )
A.SO2、Cl2均能使品红溶液褪色
B.NH4HCO3晶体、固体I2受热均能变成气体
C.S与Fe、Cu反应均生成低价硫化物
D.ClO-与S2-或H+均不能共存
[解析] SO2发生化合反应、Cl2发生还原反应,漂白原理不同,A项不正确;B项中前者是分解反应,后者是升华;D项中ClO-与S2-发生氧化还原反应而不能共存,ClO-与H+反应生成HClO而不能共存。
[答案] C
13.标准状况下H2S和O2的混合气体100 mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10 mL,该10 mL气体可能是
( )
A.H2S、SO2 B.O2
C.H2S D.SO2
[解析] H2S与氧气的反应有两种情况:
2H2S+O22S+2H2O(不完全燃烧)
2H2S+3O22SO2+2H2O(完全燃烧)
所得气体经干燥后,恢复到标准状况下,如果是不完全燃烧,则反应剩下的气体只有一种过量的反应物,由于不完全燃烧所以只能是H2S气体;如果是完全燃烧,则反应剩下的气体体积最小的情况下也只能是40 mL SO2气体(100×2/5),所以加以排除。
[答案] C
12.“在火星上找到水存在的依据”位居《Science》杂志评出的2004年十大科技突破之首,下列关于水的说法中错误的是
( )
A.水是生命活动必不可少的物质
B.水是由极性键构成的极性分子
C.水是一种极弱的电解质,温度越高电离程度越大
D.高效催化剂可使水分解获得氢气,同时释放能量
[解析] 水分解时必然吸收能量。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com