
题目列表(包括答案和解析)
2.(2009年北京理综)下列叙述正确的是
( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
[解析] A项,H2CO3、H2SO3弱酸与强酸盐BaCl2不反应,BaCO3、BaSO3都与H+反应,不可能存在于强酸性环境中;B项,加Cu(NO3)2固体后会发生:3Cu+8H++2NO===3Cu2++2NO↑+4H2O的离子反应,铜粉会溶解;C项,发生的反应依次为:Al3++3NH3·H2O===Al(OH)3↓+3NH,Al(OH)3+3H+===Al3++3H2O;D项,Zn+Cu2+===Zn2++Cu,生成的少量Cu附着在Zn粒上,形成Cu-Zn原电池,会加速产生H2的速率。
[答案] C
1.(湖南师大附中)汽车尾气中,能与人体血红蛋白结合而导致人体缺氧中毒的是( )
A.CO和CO2 B.NO和NO2
C.CO和NO D.SO2和NO2
[解析] CO、NO都能与人体血红蛋白结合而导致人体缺氧中毒。
[答案] C
14.在下列物质的转化关系中,A是一种固体单质,E是一种白色沉淀,据此填写:
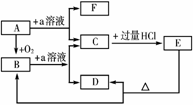
(1)B的化学式是______,目前B已被用做____________的主要原料。
(2)B和a溶液反应的离子方程式是___________________________________________。
(3)A和a溶液反应的离子方程式是_____________________________。
(4)C和过量盐酸反应的离子方程式是_________________________。
[解析] A是固体单质,则B是A的氧化物,E是一种白色沉淀,根据框图中的关系,E中应含有A元素,C中也含有A元素,在过量盐酸中能生成白色沉淀的除AgCl即是H2SiO3(或H4SiO4)。但AgCl加热分解时并不会产生氧化物,E为H4SiO4(或H2SiO3)符合题意。则B为SiO2、A为Si;C为Na2SiO3、D为H2O、F为H2。
[答案] (1)SiO2 制光导纤维
(2)SiO2+2OH-===SiO+H2O
(3)Si+2OH-+H2O===SiO+2H2↑
(4)SiO+2H+===H2SiO3↓或SiO+2H++H2O===H4SiO4↓
13.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质推测氮化硅陶瓷的用途是______。
A.制汽轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,写出该陶瓷被氢氟酸腐蚀的化学方程式__________________________________。
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅。反应的化学方程式为__________________________________。
[解析] (1)据氮化硅硬度大、熔点高等性能知为A、C、D。(2)氮化硅被HF腐蚀是由于Si与F有极强的亲合性生成了SiF4,则反应中另一产物为NH3。(3)SiCl4与N2、H2反应产物之一为Si3N4,则另一产物必是HCl。可理解为H2还原SiCl4制得Si,Si又与N2反应生成Si3N4。
[答案] (1)ACD (2)Si3N4+12HF===3SiF4↑+4NH3↑
(3)3SiCl4+2N2+6H2Si3N4+12HCl
12.(1)普通玻璃的化学式是Na2CaSi6O14,以氧化物形式可表示为____________,钾云母的化学式是K2H4Al6Si6O24,以氧化物形式表示为________________。正长石的化学式是KAlSi3Ox,x是________________,以氧化物形式表示为______________________。
(2)三硅酸镁(2MgO·3SiO2·nH2O)被用来治疗胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。写出三硅酸镁与盐酸(胃酸中含有盐酸)反应的化学方程式:____________________________________________。
[解析] 求正长石中的x值,根据化合价法,则1+3+3×4=2x x=8。
[答案] (1)Na2O·CaO·6SiO2
K2O·3Al2O3·6SiO2·2H2O 8 K2O·Al2O3·6SiO2
(2)2MgO·3SiO2·nH2O+4HCl===2MgCl2+3SiO2+(n+2)H2O
11.(2008年广东)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
焦炭高温HCl573 K以上H21 357 K
①写出由纯SiHCl3制备高纯硅的化学反应方程式________________________________________________________________________
________________________________________________________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式________________________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是________________________________________________________________________
________________________________________________________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释
________________________________________________________________________
________________________________________________________________________。
[解析] (1)①根据给定的反应物和生成物写出化学方程式,注意反应条件和配平。
②写出反应物和给出的生成物H2SiO3和HCl,用原子守恒法找出另一种生成物为H2,并配平。
(2)A项水泥是硅酸盐;B、C选项回忆课本硅的化合物的用途可知,两项说法都正确。D项玻璃是混合物没有固定熔点;E项盐酸和硅不反应。
[答案] (1)①SiHCl3+H2Si+3HCl
②SiHCl3+3H2O===H2SiO3↓+3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸;氧气可能会氧化SiHCl3
(2)BC
(3)现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成。
解释:Na2SiO3和NH4Cl均能够水解,二者相互促进,Na2SiO3水解生成H2SiO3,NH4Cl水解产生NH3。
10.背景材料:①2006年11月28日,清乾隆年间的一只蓝料款碗(如右图所示)以1亿5千万港元的天价拍卖。②2006年底受南海海域发生强裂的地震影响,多条国际海底通信光缆发生中断。③2006年10月30日,美国肯德基公司迫于社会的压力,将用于食品的反式脂肪酸全部取消。④进入2007年以来,乌鲁木齐连续11天全部为污染天气,空气污染指数居全国重点城市之最。下列有关说法正确的是
( )

A.虽然蓝料款碗以天价拍卖,但其主要成分与普通碗类似,都是硅酸盐产品
B.通信光缆的主要成分是硅橡胶
C.高级脂肪酸甘油酯是高分子化合物
D.为保证空气质量,科学合理的方法是经常进行人工降雨
[解析] 陶瓷主要成分是硅酸盐,属于硅酸盐产品,A正确;通信光缆的主要成分是SiO2,B不正确;高级脂肪酸甘油酯不是高分子化合物,C不正确;保证空气的质量,关键是减少污染,D不正确。
[答案] A
9.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是
( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
[答案] D
8.白云母是重要的无机硅酸盐材料,它的主要成分为K2Al6Si6(OH)nO18,则n为( )
A.4 B.16
C.8 D.10
[答案] C
7.生石灰中往往含有杂质碳酸钙和二氧化硅,检验是否存在这两种杂质最好选用
( )
A.水 B.盐酸
C.硫酸 D.烧碱溶液
[解析] 盐酸与CaCO3反应放出气体且使生石灰溶解,不溶物为二氧化硅。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com