
题目列表(包括答案和解析)
21.(8分)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理回答下列各小题:
(1)取A与足量的盐酸反应:
①若n(A)为定值,生成气体的量即为定值,则A的组成可能有________种。
②若m(A)为定值,生成气体的量即为定值,则A的可能组成是(填写化学式):________、________;______、________;________、________。(可以不填满)
(2)若先将A加热分解,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0 g,则n(A)=________mol。
[解析] (1)①n(A)为定值,生成气体的量即为定值,即C原子物质的量守恒,观察四种物质,当n(A)为定值,C原子的物质的量也定下来,因“四种物质中的两种混合而成”,故A的组成可能有6种。②因C原子的物质的量跟所给各物质的物质的量相等,当m (A)为定值,生成气体的量即为定值,即混合物中物质的平均摩尔质量相等,找出四种物质中摩尔质量相等的一组即是A的可能组成。(2)依题沉淀物CaCO3的质量均为10.0 g,据碳原子守恒,n(A)为碳原子物质的量的总和,即0.20 mol。
[答案] (1)①6 ②NaHCO3、MgCO3
KHCO3、CaCO3 (2)0.20
20.(10分)某化工厂为了综合利用生产过程中的副产品CaSO4与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程。
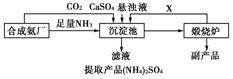
请回答以下问题:
(1)沉淀池中发生的主要反应方程式是__________________________________,该反应能够发生的原因______________________________________________________。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是________(填写序号)。
A.蒸干 B.蒸发
C.冷却结晶 D.过滤
(3)该生产过程中可以循环使用的X是________。
(4)上述生产流程中,有关NH3的作用及说明正确的是________(填写序号)。
A.提供制备所需的氮元素
B.增大CO的浓度促进反应进行
C.作反应的催化剂
D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
[解析] 沉淀池沉淀出来的物质是CaCO3,煅烧该物质可以获取生产所需的CO2。
[答案] (1)CaSO4+CO2+2NH3+H2O===CaCO3+(NH4)2SO4 生成的CaCO3的溶解度小于CaSO4,有利于反应向正向进行 (2)BCD (3)CO2 (4)ABD
19.(8分)化合物A、D、F是中学化学中最常见的物质,化合物B、C、E中含有两种相同的元素,这些化合物之间存在如图所示关系。其中A和B的反应是一种重要化工生产中的主要反应。
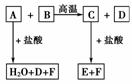
据此推断:
(1)在A、C、F中含有的相同元素是________________________________。
(2)化合物C的化学式为__________________,化合物A的水溶液呈________性。
(3)C的水溶液和D能否发生反应?__________。其理由是
________________________________________________________________________
________________________________________________________________________。
[解析] 显然,要回答题中的有关问题,必须要确定各字母所代表的具体物质。首先,根据A和B的反应是一种重要化工生产中的主要反应作为突破口来建立尝试的依据。在中学化学中所介绍的重要化工生产主要有以下几种:接触法制硫酸、氨催化氧化法制硝酸、合成氨工业、硅酸盐工业、电解饱和食盐水(即氯碱工业)、炼铁和炼钢等。根据这些化工生产的主要反应,代入进行尝试,结合框图所示的逻辑关系,不难得出这样的结论:即A和B的反应应是硅酸盐工业的主要反应。已知硅酸盐工业的主要反应为:①Na2CO3+SiO2Na2SiO3+CO2↑,②CaCO3+SiO2CaSiO3+CO2↑。把反应①和②分别代入框图进行尝试,均符合图示逻辑关系,那么反应①和②是否都可以作此题的答案呢?注意根据题中所问“化合物A的水溶液显________性”,说明物质A可溶,而CaCO3是难溶于水的,显然只有反应①是最符合题意的。
[答案] (1)钠元素 (2)Na2SiO3 碱 (3)能 碳酸的酸性比硅酸强,可发生复分解反应Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3
18.(12分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HClSiHCl3+H2
③SiHCl3与过量H2在1 000-1 100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下图所示(热源及夹持装置略去):

①装置B中的试剂是____________________。装置C中的烧瓶需要加热,其目的是________________________。
②反应一段时间后,装置D中观察到的现象是______________________,装置D不能采用普通玻璃管的原因是__________________,装置D中发生反应的化学方程式为__________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________________________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
[解析] 本题是制取高纯硅的实验,反应原理是:Si+3HClSiHCl3+H2,SiHCl3+H2Si+3HCl。因此要先制取H2,由题中信息知,SiHCl3与H2O强烈反应,且在空气中自燃,因此实验中要除去H2O,故B装置为干燥装置,实验成功还得要排净装置中的空气,又由于SiHCl3与H2需要在1 000-1 100 ℃间的高温下反应,故D用耐高温的石英管,同时还要把SiHCl3和H2通入到D中,据题中信息SiHCl3的沸点较低,故C用热水加热可以使SiHCl3挥发到D中。
[答案] (1)SiO2+2CSi+2CO↑ (2)分馏(蒸馏)
(3)①浓H2SO4 使滴入烧瓶中的SiHCl3汽化
②有固体物质生成 在反应温度下普通玻璃会软化
SiHCl3+H2Si+3HCl
③排尽装置中的空气 ④bd
106.5 6
213 kg m(H2)
m(H2)=12 kg,n(H2)=6 000 mol,V(H2)=134.4 m3。
[答案] (1)氯气 a d 浓硫酸
(2)①SiCl4+2H2+O2SiO2+4HCl ②0.35
(3)134.4
17.(14分)(2009年重庆理综)工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。

(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为______________________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
[解析] (1)电解饱和食盐水的电极反应分别为:阴极:2H++2e-===H2↑;阳极:2Cl--2e-===Cl2↑。所以阳极产物为氯气,H+在阴极放电,水中的c(OH-)增大,即NaOH在阴极(a处)产生。电解饱和食盐水所用的阳离子交换膜只允许阳离子(Na+)通过,阻止阴离子和气体通过,电解过程中,Cl-在阳极大量消耗,因此应在阳极区(d处)补充NaCl。干燥塔干燥的气体为Cl2,应用浓H2SO4。
(2)①光导纤维为SiO2,产物为两种,另一种物质只能为HCl。
②n(H2)=×20=3 mol,由
2NaCl+2H2O2NaOH+H2↑+Cl2↑
2×58.5 2
m(NaCl) 6 g
m(NaCl)=351 g≈0.35 kg。
(3)由题意,可写出反应的化学方程式为:
NaCl+3H2ONaClO3+3H2↑
16.现有CO和H2的混合气体V L,在高温下与足量氧化铁和氧化铜混合物完全反应,产物再与足量CH4混合,全部转化成CO和H2混合物(反应前后都在标准状况下)根据信息,能计算下列物理量的是
( )
①原气体中CO与H2体积比 ②参加反应的氧化铜和氧化铁质量比 ③最后得到的CO和H2总体积 ④消耗甲烷的物质的量
A.①③ B.②③
C.①④ D.③④
[解析] 发生相关化学反应有:3CO+Fe2O32Fe+3CO2,CO+CuOCu+CO2,3H2+Fe2O32Fe+3H2O,H2+CuOCu+H2O,CO2+CH42CO+2H2,H2O+CH4CO+3H2,根据反应式知,V L(CO、H2)最后得到4V L(CO、H2),同时消耗V L CH4。原混合气体中CO和H2可以是任意比。
[答案] D
第Ⅱ卷 (非选择题,52分)
15.下列饱和溶液中通入过量CO2气体,肯定无沉淀的一组是
( )
①NaOH ②Na2CO3 ③Na2SiO3 ④Ca(ClO)2 ⑤CaCl2
A.①③ B.②④
C.②⑤ D.④⑤
[解析] 饱和NaOH中通过量CO2生成NaHCO3沉淀;Na2CO3饱和溶液中通入过量CO2也生成NaHCO3沉淀;因为NaHCO3溶解度比NaOH、Na2CO3都小;通入Na2SiO3中有H2SiO3沉淀;通入Ca(ClO)2中生成Ca(HCO3)2和HClO无沉淀;与CaCl2不反应。所以④⑤中无沉淀。
[答案] D
14.PbO2微热时会分解成PbO和O2,PbO是一种不溶于水但易溶于酸的黄色物质。把适量黑褐色PbO2粉末投入热水,一边搅拌,一边通入SO2气体,结果得到白色不溶物。下列判断中错误的是
( )
A.PbO2具有氧化性
B.白色不溶物为PbSO3
C.白色不溶物是PbSO4
D.白色不溶物既是氧化产物,又是还原产物
[解析] 依题意,PbO2投入热水在搅拌条件下通入SO2,发生反应的化学方程式为2PbO2===2PbO+O2↑;2SO2+2H2O+O2===2H2SO4;PbO+H2SO4===PbSO4+H2O。叠加起来,容器内发生反应的总方程式为PbO2+SO2===PbSO4。由上式看PbO2作氧化剂,SO2作还原剂,PbSO4既是氧化产物又是还原产物。
[答案] B
13.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470 ℃ 80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是
( )
A.由二氧化碳合成金刚石是化学变化
B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠
D.金刚石中只含有非极性共价键
[解析] 本题是结合给出的信息,判断说法不正确的选项,因为金刚石是一种单质,与同位素概念没有关系,所以说“金刚石是碳的一种同位素”是错误的。A项显然是正确的;金属钠是活泼金属,可被CO2氧化为Na2O,此反应是在CO2环境下进行,Na2O与CO2反应生成了Na2CO3,所以C项正确;金刚石中只含有“C-C”非极性共价键,D项正确。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com