
题目列表(包括答案和解析)
10.将a mL NO、b mL NO2、x mL O2混合于同一试管里,将试管口倒插于水中,充分反应后试管内气体全部消失,则x对a、b的函数关系式f[x(a,b)]是
( )
A.(a+b)/2 B.(2a+b)/3
C.(3a+b)/4 D.(4a+b)/5
[解析] 由题可知当NO2与O2,NO与O2的物质的量之比分别为4∶1、4∶3时恰好完全反应,故有:x=a+b=;也可由N(N)∶N(O)=2∶5时,恰好完全反应,进行计算:=,x=。
[答案] C
9.鉴别NO2和溴蒸气不可用的是
( )
A.湿润的淀粉KI试纸 B.AgNO3溶液
C.水 D.CCl4
[解析] NO2和Br2都具有氧化性,都能把I-氧化成I2而使淀粉KI试纸变蓝,且都能在烧碱溶液中生成无色物质。NO2和Br2的水溶液颜色不一样,溴水为橙色,Br2在CCl4中呈橙色,NO2不溶于CCl4。另外Br2通入AgNO3溶液中能产生浅黄色沉淀。
[答案] A
8.下列各项性质的递变规律错误的是
( )
A.沸点:NH3<PH3<AsH3
B.非金属性:N>P>As
C.还原性:AsH3>PH3>NH3
D.酸性:HNO3>H3PO4>H3AsO4
[解析] 根据氮族元素性质递变规律,B、C、D均符合规律。NH3的式量最小,但NH3分子易形成氢键,沸点比PH3高。
[答案] A
7.某元素R原子的最外层有5个电子,它的含氧酸的钾盐化学式不可能的是( )
A.KRO3 B.K3RO4
C.KRO2 D.K2RO4
[解析] 由题意知,该元素位于第ⅤA族,常见化合价有+3、+5价。其+3价含氧酸的化学式为HRO2或H3RO3,由此可知C正确。+5价常见含氧酸的化学式为HRO3或H3RO4,由此可知选项A、B正确,而D选项中R为+6价,故D不可能。
[答案] D
6.下列说法正确的是
( )
A.白磷和红磷在一定条件下相互转化,发生的是物理变化
B.干冰汽化时,需要破坏化学键
C.能与酸反应的氧化物一定是碱性氧化物
D.金属阳离子被还原不一定得到金属单质
[解析] A项,白磷与红磷分子结构不同,属于磷元素的两种不同单质,它们之间的变化属于化学变化;B项,干冰汽化时,只需破坏分子间作用力即可;C项,举Al2O3,属于两性氧化物,D项,举2Fe3++2I-===2Fe2++I2,说明D项正确。
[答案] D
5.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不正确的是
( )
A.NO分子中有极性共价键
B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一
D.NO分子所含电子总数为偶数
[解析] NO中氮元素与氧元素的非金属性不同,形成的共价键是极性共价键,A正确;光化学烟雾简介:汽车尾气中的氮氧化合物与碳氢化合物经紫外线照射发生反应形成一种有毒的烟雾,称为光化学烟雾。光化学烟雾具有特殊气味,刺激眼睛,伤害植物,并使大气能见度降低。空气中的NO2是造成光化学烟雾的主要原因。氮氧化合物是形成光化学烟雾和酸雨的重要原因之一,B正确;NO、NO2是汽车尾气的有害成分之一,C正确;NO分子所含的电子总数为15,故D是错误的。
[答案] D
4.在容积为672 mL的烧瓶里充满NO、NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且水充满烧瓶(气体体积都折合成标准状况下)。下列有关叙述中正确的是
( )
A.总反应为NO+NO2+O2+H2O===2HNO3
B.总反应为4NO+8NO2+5O2+6H2O===12HNO3
C.生成HNO3的物质的量浓度接近0.03 mol·L-1
D.生成HNO3的物质的量浓度约为0.045 mol·L-1
[解析] 本题考查NO、NO2的混合气体与氧气在水中反应的比例关系。无论是NO还是NO2都能在水中与氧气按一定比例反应生成HNO3,同温、同压下,气体的物质的量之比等于体积之比,n(NO+NO2)∶n(O2)=672∶280=12∶5。所以由电子守恒可知恰好反应时总反应为4NO+8NO2+5O2+6H2O===12HNO3。可以生成0.03 mol HNO3,容器的容积为672 mL,所以硝酸的物质的量浓度约为0.03 mol/0.672 L=0.045 mol·L-1。
[答案] BD
3.奥运会上使用的发令枪,所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为5KClO3+6P===3P2O5+5KCl,则下列有关叙述错误的是
( )
A.上述反应中氧化剂与还原剂的物质的量之比为5∶6
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.上述反应中消耗3 mol P时,转移电子的物质的量为15 mol
D.因红磷和白磷互为同素异形体,所以上述火药中的红磷可以用白磷代替
[解析] 本题主要考查磷元素单质及化合物的性质。题中反应的氧化剂为KClO3,还原剂为红磷,n(KClO3)∶n(P)=5∶6;P2O5白色固体颗粒在空气中扩散形成白烟,P2O5吸水并反应生成H3PO4,H3PO4小液滴在空气中扩散形成雾;根据题中反应的化学计量数,消耗3 mol P时转移15 mol e-;白磷有剧毒且容易自燃,因此不能用白磷代替红磷。
[答案] D
2.如下图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
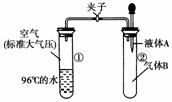
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
[解析] 由于试管①中96 ℃水此时沸腾了,说明整个系统内部的压强减小了,即②中的气体被消耗使气体的物质的量减小,结合选项可知只有C项中气体的物质的量保持不变,其他几项中气体的物质的量均会减小。
[答案] C
1.砷为第四周期第ⅤA族元素,根据其在元素周期表中的位置推测,砷不可能具有的性质是
( )
①砷原子比磷原子原子核外多一个电子层,共多8个电子 ②砷酸H3AsO4是一种氧化性强酸 ③砷能表现出一定的金属性 ④砷难与H2化合,砷化氢极不稳定 ⑤砷在通常状况下是固体 ⑥可以有-3、+3、+5等多种化合价 ⑦As2O5对应水化物的酸性比H3PO4弱
A.①③④ B.①②
C.⑥⑦ D.②④⑥
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com