
题目列表(包括答案和解析)
6.如右图所示,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是
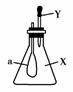 ( )
( )
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
[解析] 气球鼓起,说明锥形瓶内压强减小,所以只要气体溶于液体或与液体反应使压强减小即可。A、D中NH3、HCl极易溶于水,B中SO2与NaOH反应。
[答案] C
5.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
( )
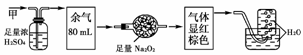
A.NH3、NO2、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
[解析] 因是无色混合气体,证明没有NO2的存在,故A、C错误,又经过系列实验的处理得酸性溶液且通过足量Na2O2后显红棕色,最后通入水中无气体剩余,证明甲气体中无N2,应存在NH3、NO、CO2气体,故B正确。
[答案] B
4.氢化铵与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述中不正确的是
( )
A.NH4H是离子化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是氧化剂
D.NH4H固体投入少量的水中,有两种气体产生
[解析] 利用类比方法:NH4H+H2O===NH3·H2O+H2↑(当水少溶液浓度大NH3·H2O===NH3↑+H2O溶液应为碱性,且NH4H作还原剂)。
[答案] BC
3.同主族元素所形成的同一类型的化合物结构和性质往往相似,已知化合物PH4I是一种无色晶体,试判断下列对其描述正确的是
( )
A.PH4I是共价化合物,属于分子晶体
B.PH4I对热不稳定,受热分解生成无色气体
C.PH4I不能与NaOH反应
D.PH4I可由PH3与HI化合而成
[解析] PH4I类似于NH4Cl属于离子化合物,可与碱反应,但受热分解生成的HI可继续分解成H2和I2(紫色)。
[答案] D
2.密度为0.91 g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液里溶质的质量分数为
( )
A.等于12.5% B.大于12.5%
C.小于12.5% D.无法确定
[解析] 氨水和水等质量混合时,质量分数为12.5%,而与氨水等质量的水的体积比氨水的体积小,因此等体积混合时,12.5%的氨水被稀释。
[答案] C
1.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为
( )
A.①>② B.①<②
C.①=② D.不能确定
[答案] C
14.(2009年全国Ⅰ理综)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是___________________________________;
(2)Q的具有相同化合价且可以相互转变的氧化物是______________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是______________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)______________,其原因是___________________________________________________;
②电子总数相同的氢化物的化学式和立体结构分别是
________________________________________________________________________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是________________________________________________________________________
________________________________________________________________________。
[解析] W的氯化物为正四面体结构,通常应是SiCl4或CCl4,W与Q形成高温结构陶瓷,可推出W为Si,Q为N。再结合其他条件可推出X为P,Y为S,R为As。
[答案] (1)原子晶体 (2)NO2和N2O4 (3)As2S5
(4)①NH3、AsH3、PH3 NH3分子间存在氢键,所以沸点最高,相对分子质量AsH3大于PH3,分子间作用力AsH3大于PH3,故AsH3沸点高于PH3
②SiH4正四面体,PH3三角锥,H2S角形(V形)
(5)SiCl4+4NH3Si(NH2)4+4HCl
3Si(NH2)4Si3N4+8NH3↑
13.短周期元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物,请回答:
(1)X元素的名称是________;Y元素的名称是______;Z元素的名称是________。
(2)XZ3化合物的分子式是______,电子式是________。
(3)分别写出X、Y的含氧酸的分子式______、________。
[解析] 由Y作为解题的突破口。短周期元素Y原子的最外电子层上的电子数是它的电子层数的2倍,可以推断Y为碳,不可能是硫(因为硫有3个电子层,那么另外两种元素只能是H和He,与题意不符)。Z、Y、X的原子序数依次增大且原子核外共有5个电子层,所以Z的核外是1个电子层,X的核外是2个电子层。X、Z可形成化合物XZ3,可以确定Z是氢,X是氮。
[答案] (1)氮 碳 氢 (2)NH3 H··\o(\s\up7(H\s\do5(·· ··H
(3)HNO3 H2CO3
12.NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于______________(填以下项目的编号)。
A.破坏臭氧层
B.高温下能使一些金属被氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO。写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:
________________________________________________________________________。
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50 °C,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式: ____________________________________________
________________________________________________________________________。
(4)解释变化(3)中为什么最后的气体总压力小于原压力的2/3?
[解析] (1)NO有毒,是因为与人体血液中血红蛋白结合。而NO对环境的污染,是指破坏臭氧层、产生光化学烟雾以及形成酸雨等,故选AC。
(2)由所示信息:Cu++NO+H+NO↑+…可以推断其他产物为Cu2+、H2O,然后再配平。
(3)根据2NO―→N2O可知,N元素的化合价降低2价,故必然有另一化合价升高2的变化,得另一种产物为NO2。
(4)根据2NO2N2O4,知压力略小于原来的2/3。
[答案] (1)AC
(2)Cu++NO+2H+===Cu2++NO↑+H2O
(3)3NO===N2O+NO2
(4)生成的NO2又发生了反应:2NO2
 N2O4,从而使压力略小于原来的2/3。
N2O4,从而使压力略小于原来的2/3。
11.实验室可通过多条途径得到氮气,常见的三种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜。
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
下列是进行实验时可选择的实验仪器(其他必要的仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未列出):
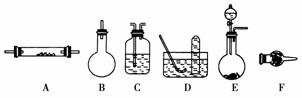
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)________作发生装置,该反应的化学方程式____________________________________。要制取并收集纯净的氮气(可含有少量的水),还使用上述仪器中的(填仪器的编号,并按气流方向从左向右列出)______________________。
(2)在制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于 _____________________________。
[答案] (1)E CaO+NH3·H2O===NH3↑+Ca(OH)2
E→F→A→C→D (2)Cu和CuO可以循环使用,避免因使用有毒的物质NaNO2而造成污染
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com