
题目列表(包括答案和解析)
2.现有下列物质,其中必须保存在棕色瓶里的是
( )
①氯水 ②氨水 ③浓硝酸 ④氢氧化钠 ⑤溴
A.全部 B.①③和⑤
C.只有①和③ D.①②和④
[解析] 氯水见光发生反应2HClO2HCl+O2↑而变质,浓硝酸见光分解:4HNO34NO2↑+O2↑+2H2O,为防止它们分解变质,必须贮存在棕色瓶里。
[答案] C
1.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是
( )
A.测定密度 B.放入硝酸中
C.放入盐酸中 D.观察外观
[解析] 铜锌合金也称黄铜,其外观与黄金相似,但其密度比黄金小,因其含有锌单质,放入硝酸、盐酸中都能反应,而黄金不与硝酸、盐酸反应。
[答案] D
14.(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A________;B________;C________;D________。
(2)写出A、B、E三种微粒反应的离子方程式:___________________________________。
(Ⅱ)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
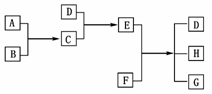
请回答下列问题:
(1)D的化学式是________,E的化学式是________。
(2)A和B反应生成C的化学方程式是:
________________________________________________________________________
________________________________________________________________________。
(3)E和F反应生成D、H和G的化学方程式是:
________________________________________________________________________。
[解析] (Ⅰ)10e-微粒B溶于A后……―→A为H2O、B为NH3,C为NH,D为OH-,E为Mg2+或Al3+―→(2)的离子反应方程式。
(Ⅱ)本题的突破口在于D→E→D这一系列过程,其对应氨气→铵盐→氨气这一过程。也就是D为NH3,结合G为CaCl2可以知道E为NH4Cl,F为Ca(OH)2。其余物质可以逐一确定为A为H2(或Cl2)、B为Cl2(或H2)、C为HCl、H为H2O。
[答案] (Ⅰ)(1)H2O NH3 NH OH-
(2)Al3++3NH3+3H2O===Al(OH)3↓+3NH或
Mg2++2NH3+2H2O===Mg(OH)2↓+2NH
(Ⅱ)(1)NH3 NH4Cl (2)H2+Cl22HCl
(3)2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2
13.(2008年上海)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。

|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10 mL FeSO4溶液 |
10 mL NH3 |
生成白色沉淀,后变色 |
|
2 |
20 mL H2S |
10 mL SO2 |
|
|
3 |
30 mL NO2(主要) |
10 mL H2O(l) |
剩有无色气体,活塞自动向内压缩 |
|
4 |
15 mL Cl2 |
40 mL NH3 |
|
请回答下列问题:
(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式________________________________________________________________________。
(2)实验2甲针筒内的现象有:有________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入________溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是________,写出NO2与H2O反应的化学方程式_______________________________
________________________________________________________________________。
(4)实验4中,已知:3Cl2+2NH3―→N2+6HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为________________,最后针筒内剩余气体的体积约为________mL。
[解析] 在(2)中实验2发生的反应为:2H2S+SO2===3S↓+2H2O,二者反应有单质硫生成,同时气体几乎完全消失。在(3)中随着NO2与水不断反应,N2O4会逐渐转化为NO2并最终完全与水反应生成HNO3和NO。在(4)中有白烟产生是因为过量的NH3与HCl反应生成了NH4Cl,最终针筒里的气体只有N2。
[答案] (1)红褐 4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)黄色固体 向内 NaOH
(3)NO 3NO2+H2O===2HNO3+NO
(4)黄绿色变为无色 5
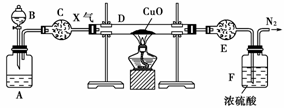
12.(2007年北京理综)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知:a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子含10个电子,乙分子含18个电子。
(1)X的电子式是____________________________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)_____________________ _________________________。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)____________________________________ __________________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是______________________________。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是___________________________________________________。
[解析] 短周期除惰性气体外的气体单质有H2、N2、O2、F2、Cl2。由已知a知X为N2,由b知,甲为NH3,乙为HCl,丙为NH4Cl。
(1)一定要从化学键的形成角度掌握常见物质的电子式,如N2、CO2、CH4、NH3、H2O、Na2O2等。
(2)①NH3的收集应是向下排空气法。②NH3的制取用铵盐与碱反应,但铵盐一般不用NH4NO3,防止爆炸。碱一般用Ca(OH)2,不用NaOH,因NaOH对玻璃的腐蚀作用太强。③要注意“”。
(3)P与Cl2反应生成PCl3和PCl5,PCl3的电子式为
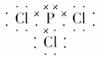 各原子最外层均为8电子结构,所以丁为PCl5。
各原子最外层均为8电子结构,所以丁为PCl5。
(4)由“化学方程式中各物质的计量数之比等于物质的量之比”及质量守恒定律共同得出。n mol PCl5与n mol NH4Cl反应生成4n mol HCl,由质量守恒定律知所求物分子中P、N、Cl的原子个数比为N(P)∶N(N)∶N(Cl)=1∶1∶2,所求物的相对分子质量为174×2,二者结合得出未知物的化学式为P3N3Cl6。
[答案] (1)∶N⋮⋮N∶
(2)①

②NH4Cl、Ca(OH)2(合理答案均可)
③NH3·H2O
 NH+OH- (3)PCl5 (4)P3N3Cl6
NH+OH- (3)PCl5 (4)P3N3Cl6
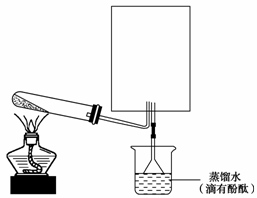
11.如下图所示是某气体X产生并研究其性质的装置。
A中盛有能与水剧烈反应并放热的白色固体,B中盛有无色挥发性液体,C和E盛有干燥剂。A和B中物质相遇时有无色气体X生成,它经图中一系列装置在末端得到N2,且E管的质量增加。
(1)写出盛放试剂的名称:
A._______,B._______,C._______,E._______。
(2)A和B中物质相遇生成X的主要原因是:__________________________________。
(3)D中反应的化学方程式_____________________________________________。
(4)F中反应的化学方程式_____________________________。
(5)从D中反应说明气体X具有______(填“酸性”“碱性”“氧化性”或“还原性”)。
[答案] (1)A.生石灰 B.浓氨水 C.碱石灰 E.碱石灰
(2)CaO与水化合生成熟石灰,消耗水并放出大量热,使浓氨水中的NH3逸出
(3)3CuO+2NH3N2+3Cu+3H2O
(4)2NH3+H2SO4===(NH4)2SO4 (5)还原性
10.如下图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是
( )
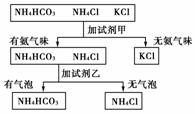
A.甲:Ca(OH)2;乙:稀盐酸
B.甲:水;乙:氢氧化钠溶液
C.甲:氢氧化钠溶液;乙:水
D.甲:稀盐酸;乙:氯化钠溶液
[解析] 加试剂甲有NH3放出,与铵盐反应生成NH3,试剂甲应为碱,试剂乙应为酸。答案为A。
[答案] A
9.氨的三硼化物时下被吹捧为“化学储氢应用中最有希望的新材料”,其结构简式如图所示,其可由B3H7经无水NH3处理而得。有关说法正确的是
( )

A.上述合成氨的三硼化物的反应属于化合反应
B.氨的三硼化物为烃的衍生物
C.氨的电子式为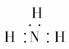
D.硼(B)在元素周期表的位置为第二周期、第ⅢB族
[解析] 氨的三硼化物为无机物;氨的电子式中N的最外层电子还缺一对;B在元素周期表的位置为第二周期、第ⅢA族,从结构简式可得其分子式为NB3H10,刚好由一个B3H7、NH3化合而成,故该反应属于化合反应。
[答案] A
8.将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),该b L气体中NH3的体积分数是
( )
A. B.
C. D.
[解析] 用差量法求解。
2NH3N2+3H2 ΔV
2 1 3 2
x b-a
设有x L NH3分解,则气体体积将增加x L,所以有x=b-a,故平衡时NH3的体积分数是=。
[答案] C
7.把a L含(NH4)2SO4和NH4NO3的混合液分成两等份。一份用b mol烧碱刚好把NH3全部赶出;另一份与BaCl2溶液恰好完全反应,消耗c mol BaCl2,则原溶液中c(NO)为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
[解析] 依题意知:每一份混合液中n(NH)=b mol;n(SO)=n(BaCl2)=c mol,原溶液中n(NH)为2b mol,n(SO)=2c mol。
(NH4)2SO4===2NH + SO
4c mol 2c mol
则由NH4NO3提供的NH为(2b-4c)mol,
c(NO)= mol·L-1。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com