
题目列表(包括答案和解析)
9.14 g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12 L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是
( )
A.9.6 g B.6.4 g
C.3.2 g D.4.8 g
[解析] Cu、Ag合金与HNO3反应过程如下:
14 g Cu、Ag合金与HNO3反应,若是浓HNO3,还原产物是NO2或NO2与NO的混合物(随反应进行浓HNO3逐渐变稀);若是稀HNO3,则还原产物是NO。该反应是氧化还原反应,Cu、Ag失电子,HNO3得电子,生成NO2或NO。由于NO2、NO和O2都被水吸收生成HNO3,即NO2、NO又将电子转移给O2,所以在整个反应过程中,相当于Cu、Ag失去的电子转移给0.05 mol O2;0.05 mol O2得电子数:0.05×4=0.2 mol,即Cu、Ag共失去0.2 mol电子。设Cu为x mol、Ag为y mol,则
所以铜的质量为m(Cu)=64 g/mol×0.05 mol=3.2 g。
[答案] C
8.铜和镁的合金4.60 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL的NO2气体和336 mL的N2O4气体(均为标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
( )
A.13.0 g B.7.05 g
C.8.51 g D.15.6 g
[解析] CuCu2+Cu(OH)2
MgMg2+Mg(OH)2
生成Cu(OH)2、Mg(OH)2的质量应是Cu、Mg质量加上转移电子的物质的量×17 g/mol(OH-摩尔质量)转移电子为:×1=0.23 mol,
沉淀质量为:4.60 g+0.23 mol×17 g/mol=8.51 g。
[答案] C
7.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:①Cu与稀硝酸反应制取,3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O;②Cu与浓硝酸反应制取,Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O;③首先用氧气氧化铜屑生成氧化铜,氧化铜与稀硝酸反应制取,2Cu+O22CuO;CuO+2HNO3===Cu(NO3)2+H2O。下列说法不正确的是
( )
A.制取相同量的硝酸铜需硝酸的量③最少
B.制取相同量的硝酸铜①产生的有毒气体比②少
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
[解析] 由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1 mol Cu(NO3)2①中放出2/3 mol NO气体,硝酸的利用率为3/4 ②中放出2 mol NO2气体,硝酸的利用率为1/2 ③中没有气体放出,HNO3的利用率为100%,而稀硝酸与铁发生反应,且生成的Cu(NO3)2与铁反应。
[答案] D
6.在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别为0.4 mol·L-1和0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热,充分反应后,所得溶液中的Cu2+浓度为( )
A.0.225 mol·L-1 B.0.375 mol·L-1
C.0.450 mol·L-1 D.无法计算
[解析] 依题意n(H+)=2n(H2SO4)+n(HNO3)=2×0.01 mol+0.04 mol=0.06 mol,n(NO)=0.04 mol,n(Cu)=0.03 mol,按3Cu+8H++2NO===3Cu2++2NO↑+4H2O反应,n(H+)不足,用n(H+)和方程式共同求得c(Cu2+)=0.225 mol·L-1,故选A。
[答案] A
0.2 mol 0.8 mol 0.2 mol 0.2 mol
加入0.2 mol Fe时正好生成0.2 mol Fe(NO3)3及0.2 mol NO气体,再加入0.1 mol Fe粉,发生反应2Fe(NO3)3+Fe===3Fe(NO3)2,气体的物质的量不再变化。
[答案] C
5.将22.4 g铁粉逐渐加入含HNO3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中,正确的是
( )
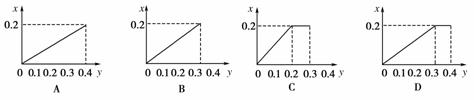
[解析] 开始HNO3过量,发生反应:
Fe + 4HNO3 ===Fe(NO3)3+ NO↑+2H2O
4.将3.2 g Cu跟30.0 mL、10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2。若反应后溶液中有a mol H+离子,则此时溶液中含NO离子的物质的量为
( )
A.0.5a mol B.(0.1+a)mol
C.0.1a mol D.2a mol
[解析] 反应后:n(Cu2+)==0.05 mol
由电荷守恒知:n(NO)=(0.1+a)mol。
[答案] B
0.25 mol×x=(1 mol-0.25 mol×x)×(5-4)
x=2,为+2价。
[答案] BD
0.25 mol×x=1 mol×(5-4)(浓HNO3被还原为NO2)
x=4,为+4价。
单质也可能为金属单质,反应后为硝酸盐,反应掉的HNO3一部分作氧化剂,则:
3.某单质跟浓硝酸反应时,0.25 mol单质完全反应就消耗1 mol HNO3,则单质元素氧化后的化合价可能是
( )
A.+1 B.+2
C.+3 D.+4
[解析] 单质可能为非金属单质,反应掉的HNO3都作氧化剂,设单质元素氧化后的化合价为x,据得失电子数相等,则有如下关系:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com