
题目列表(包括答案和解析)
4.同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件中最佳组合是( )
①纯锌粒;②粗锌片;③0.01 mol·L-1盐酸;④0.01 mol·L-1硫酸;⑤98%硫酸;⑥加热; ⑦用冰水冷却
A.①③⑦ B.②④⑥
C.②③⑥ D.①⑤⑥
[解析] 根据影响锌与酸反应速率的外界因素,如浓度、温度、颗粒大小等,同时考虑原电池原理,采取粗锌片、0.01 mol·L-1硫酸和加热条件,使反应速率最大,即选B。
[答案] B
3.设C+CO2 2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2 2NH3(正反应为放热反应),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
2NH3(正反应为放热反应),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
[解析] 升高温度,无论反应是吸热反应还是放热反应,反应速率均增大。
[答案] A
2.反应2SO2+O2 2SO3经一段时间后SO3浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
2SO3经一段时间后SO3浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为
( )
A.0.1 s B.2.5 s
C.5 s D.10 s
[解析] v(SO3)=2v(O2)=2×0.04 mol·L-1·s-1
Δt===5 s。
[答案] C
1.在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率增大的措施是
C(g)+D(g)正反应速率增大的措施是
( )
A.减小C或D的浓度 B.增大D的浓度
C.减小B的浓度 D.增大A或B的浓度
[解析] 本题考查浓度对化学反应速率的影响,根据增大反应物浓度可加快化学反应速率可知,欲使正反应速率增大,应增大反应物A或B的浓度。本题中涉及的问题应注意与化学平衡移动问题区别开。
[答案] D
21.(10分)硝酸工业尾气中氧化物(NO、NO2)是大气污染物,可用于下述反应的方法治理:2NO2+2NaOH===NaNO2+NaNO3+H2O,NO2+NO+2NaOH===2NaNO2+H2O,现有标准状况下a L NO2和b L NO的混合气体(本题不考虑N2O4的存在),恰好可被200 mL NaOH溶液完全吸收。
(1)欲保证工业尾气全部被吸收,则a∶b的值应控制在________________范围。
(2)NaOH溶液的物质的量浓度是________mol·L-1(用含a、b的代数式表示)。
(3)试讨论a、b的值与生成的NaNO3和NaNO2的物质的量(设分别为n1,n2)之间的关系:(用含a、b的代数式表示)
①当生成的产物全部为NaNO2时,n2与a、b的关系;
②当产物中兼有NaNO3和NaNO2时,n1、n2与a、b的关系。
(4)若在标准状况下有NO、NO2的混合物恰好与50 mL 2.0 mol·L-1的NaOH溶液完全反应,且生成NaNO2和NaNO3的物质的量的比值为4∶1,则在混合气体中NO气体的体积分数多大?________。
[答案] (1)a∶b≥1 (2)
(3)①n2= mol ②n1= mol;n2= mol
(4)30%
20.(9分)下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用做工业上冶炼金属的还原剂。

请按要求填空:
(1)写出下列物质的化学式:A:______;B:________;C:________。
(2)写出A→D的化学方程式________________________。
(3)写出G和I的浓溶液反应的化学方程式______________________________________。
[解析] H可用做工业上冶炼金属的还原剂,为气态,且可由固体G与气体E反应得来,可以确定H为一氧化碳,根据反应条件“点燃”、“高温”确定C为二氧化碳,E为氧气,G为碳,根据反应条件“通电”,大胆猜测B为常见的液体水,碳能与I的浓硫酸反应生成二氧化碳,猜想I为硝酸,然后根据框图验证猜测的正确性,从而得出答案。
[答案] (1)NH3 H2O CO2
(2)4NH3+5O2催化剂△4NO+6H2O
(3)C+4HNO3(浓)CO2↑+4NO2↑+2H2O
19.(10分)下图1为实验室制取氨的实验装置。
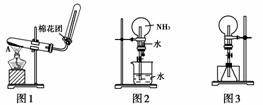
(1)写出A中所发生反应的化学方程式_________________________________。
(2)该装置还可以制备哪些气体________。试管口略向下倾斜的原因是________________________________________________________________________。
(3)在收集氨时试管口棉花的作用是_________________________________。
(4)一位学生用制得的氨,按图2装置进行喷泉实验,烧瓶已充满干燥的氨气,引发喷泉实验的操作是______________________________________________。
(5)另一学生积极思考产生喷泉的其他方法,设计图3装置。首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是(填编号字母)________。
A.CaCO3粉末和浓HCl
B.NH4HCO3溶液与稀NaOH溶液
C.HCl和AgNO3溶液
D.HCl和酚酞溶液
该同学又向锥形瓶中加入酒精,水槽加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是(填编号字母)________。
A.硝酸铵 B.食盐
C.浓硫酸 D.硫酸铜
[解析] (1)采用的是固+固混合加热型制气的方法,故用氯化铵和氢氧化钙固体混合加热,反应方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
(2)用该装置还可以制备O2和CH4;试管口略向下倾斜的原因是防止生成的水倒流,使热的试管炸裂。
(3)收集氨气用的是向下排空气法,试管口棉花的作用是减少氨气与空气的对流,加快收集的速率,同时保证试管中能收集满氨气。
(4)打开橡皮管的夹子,挤压胶头滴管的胶头,使少量的水进入烧瓶,由于氨气易溶于水,使烧瓶中的气体压强减小,引起喷泉。
(5)图3是利用反应生成大量的气体,由气体自身产生的压强将液体压上去而产生喷泉,故A可以;在锥形瓶中加入酒精,则需将酒精汽化才能形成喷泉,故需加入在冷水中能够放出大量热量的物质才可以,即加入浓硫酸。
[答案] (1)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(2)O2和CH4 防止生成的水倒流,使热的试管炸裂
(3)减少对流,保证试管中能收集满氨气
(4)打开橡皮管的夹子,挤压胶头滴管的胶头,使少量的水进入烧瓶 (5)A C
18.(12分)实验室用氨气还原氧化铜的方法测定铜的相对原子质量,反应的化学方程式为:
2NH3+3CuON2+3Cu+3H2O
(1)如果选用测定反应物CuO和生成物H2O的质量m(CuO)、m(H2O)时,请用下图所示的仪器设计一个简单的实验方案。

①仪器连接的顺序(填编号,仪器可重复使用)是__________。D中浓硫酸的作用是________________________________________________________________________
__________________________。
实验完毕时,观察到A中的现象是 _______________________________________
____________。
②列出计算Cu的相对原子质量的表达式:
________________________________________________________________________。
③下列情况将使测定结果偏大的是__________。
a.CuO未全部还原为Cu b.CuO受潮
c.CuO中混有Cu
(2)如果仍采用如图所示的仪器装置,设计其他方案,还可测定的物理量有__________。
a.m(Cu)和m(CuO) b.m(N2)和m(H2O)
c.m(Cu)和m(H2O) d.m(NH3)和m(H2O)
[解析] (1)①NH4Cl和Ca(OH)2反应可以生成NH3,经碱石灰干燥后,把NH3通入A装置,发生主体反应。将反应后生成的水蒸气用C装置吸收。多余的NH3用浓H2SO4吸收,同时也防止空气中的水蒸气进入第二个C装置中。
②设Cu的相对原子质量为x,有
2NH3+3CuON2+3Cu+3H2O
3(x+16) 3×18
m(CuO) m(H2O)
x=-16
③要使测定结果偏大,则m(CuO)要偏大,m(H2O)要偏小,其中a导致m(H2O)偏小,b导致m(H2O)偏大,c相当于m(H2O)偏小,选a、c。
(2)由于气体难于收集,质量也难于测量,所以b、d是不可选用的,且b、d给出的量无法计算出Cu的相对原子质量。
[答案] (1)①BCACD 吸收未反应的氨,防止空气中水分进入第二个C装置中 固体由黑色转变为红色
②-16 ③ac
(2)ac
17.(11分)磷化氢(PH3)是无色剧毒气体其中含微量P2H4而易自燃。其制取原理类似于实验室制氨气,现用下图所示装置制取PH3并验证其性质。
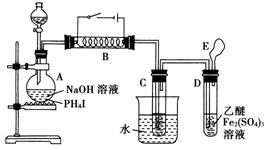
请回答:
(1)有碘化磷(PH4I)和烧碱反应制取PH3的化学方程式为
________________________________________________________________________。
(2)实验开始时,先从分液漏斗中往盛有碘化磷的烧瓶A中加入过量乙醚[无色液体,沸点34.5 °C微溶于水,不与Fe2(SO4)3反应],微热数分钟后再从分液漏斗中向烧瓶里加入一定量的浓NaOH溶液继续加热。在B处用电热器控制温度在300 °C左右,实验过程中可观察到:
①用水冷却在C中有白色蜡状固体生成。
②D试管中Fe2(SO4)3溶液的颜色由棕黄色变成淡绿色,同时也有白色蜡状物生成。
③E处点燃尾气,呈淡蓝色火焰。则:C中的白色蜡状固体是________(填分子式),能说明PH3具有________的性质。试管D中反应的化学方程式是___________________
__________________说明PH3具有______性。
(3)实验时E处尾气须点燃,原因是 ___________________________
________________。
(4)实验开始时,先向烧瓶中加入乙醚并微热,其目的是
________________________________________________________________________。
[答案] (1)PH4I+NaOHPH3↑+NaI+H2O
(2)P4 易分解 4PH3+6Fe2(SO4)3===P4+12FeSO4+6H2SO4 还原 (3)PH3有毒,不能排入大气
(4)乙醚密度大,能自下而上排尽装置内空气
16.工业生产中物质的循环利用有多种模式。例如:
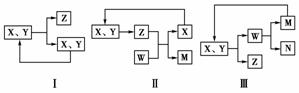
下列表述正确的是
( )
A.图Ⅰ可用于合成氨中N2、H2的循环
B.图Ⅰ可用于氨碱法制纯碱中CO2的循环
C.图Ⅱ可用于电解饱和食盐水中NaCl的循环
D.图Ⅲ可用于氨氧化法制硝酸中NO的循环
[解析] 本题考查的是对图形的认知及工业生产原理的理解。A正确;B中的氨碱法制纯碱的原理是NH3+CO2+H2O+NaCl===NH4Cl+NaHCO3↓,由于反应物有四种,而Ⅰ图中的反应物只有两个,所以B错;同理电解食盐水的生成物有NaOH、Cl2、H2,图Ⅱ中的X+Y===Z,只有一个生成物,所以C错;D中氨氧化法制硝酸的原理是氨的催化氧化、NO的氧化、NO2的氧化,而图Ⅲ中W―→M+N,很明显不符合反应事实,故D也不对。
[答案] A
第Ⅱ卷 (非选择题,52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com