
题目列表(包括答案和解析)
12.已知反应mX(g)+nY(g)
 qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
[解析] 可逆反应在恒容密闭容器中达到平衡时,向其中通入稀有气体,由于影响平衡移动的条件没有改变,平衡不移动;降低温度,平衡右移,气体的质量不变,气体的物质的量减少,平衡相对分子质量应变大;增加反应物X的物质的量,能提高另一反应物Y的转化率。
[答案] B
11.在一定条件下,固定容积的密闭容器中反应:2NO2(g)
 O2(g)+2NO(g);ΔH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合右图所示曲线的是
O2(g)+2NO(g);ΔH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合右图所示曲线的是
( )
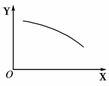
①当X表示温度时,Y表示NO2的物质的量
②当X表示压强时,Y表示NO2的转化率
③当X表示反应时间时,Y表示混合气体的密度
④当X表示NO2的物质的量时,Y表示O2的物质的量
A.①② B.②③
C.③④ D.①④
[解析] 升高温度,平衡向右移动,n(NO2)减少;增大压强,平衡向左移动,NO2转化率减小,所以①、②正确。平衡后,平衡混合气的密度不随时间改变;增大n(NO2),平衡向右移动,n(O2)增多,所以③、④错误。
[答案] A
10.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)
 2C(g)达到平衡,测得平衡时A、B、C物质的量之比n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B和C,下列判断中不正确的是
2C(g)达到平衡,测得平衡时A、B、C物质的量之比n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以2∶2∶1的物质的量之比再充入A、B和C,下列判断中不正确的是
( )
A.平衡向正反应方向移动 B.平衡不会发生移动
C.C的质量分数增大 D.B的质量分数减小
[解析] 相当于增大压强,平衡向正反应方向移动。C的质量分数增大,B的质量分数减小。
[答案] B
9.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(g)+B(g)
 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
[答案] C
8.α1和α2分别为A在两个恒容容器中平衡体系A(g)
 2B(g)和2A(g)
2B(g)和2A(g)
 B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
( )
A.α1、α2均减小 B.α1、α2均增大
C.α1减小,α2增大 D.α1增大,α2减小
[解析] 在理解转化率概念的基础上进行勒夏特列原理的二次运用,对于反应:A(g)
 2B(g)①,2A(g)
2B(g)①,2A(g)
 B(g)②。在恒温,恒容条件下达到平衡时,A的转化率分别为α1、α2,保持条件不变,增加A的物质的量,第一次运用勒夏特列原理判断两平衡均应向右移动。但对平衡①来说,A的转化促使B的物质的量以A的转化物质的量的2倍增加,第二次运用勒夏特列原理判断,最终原平衡向左移动,即α1减小;对②来说原来平衡只能向右移动,即α2增大。
B(g)②。在恒温,恒容条件下达到平衡时,A的转化率分别为α1、α2,保持条件不变,增加A的物质的量,第一次运用勒夏特列原理判断两平衡均应向右移动。但对平衡①来说,A的转化促使B的物质的量以A的转化物质的量的2倍增加,第二次运用勒夏特列原理判断,最终原平衡向左移动,即α1减小;对②来说原来平衡只能向右移动,即α2增大。
[答案] C
7.某温度下在密闭容器中发生如下反应:2M(g)+N(g)
 2E(g),
2E(g),
若开始时只充入2 mol E,达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为
( )
A.20% B.40%
C.60% D.80%
[解析] 恒温、恒容条件下,开始充入2 mol E与开始充入2 mol M和1 mol N完全等效。由题意知
平衡时n(总)=2 mol×(1+20%)=2.4 mol
设M转化率为a,则
2M(g)+N(g)
 2E(g)
2E(g)
n始 2 1 0
Δn 2a a 2a
n平 2-2a 1-a 2a
所以:2-2a+1-a+2a=2.4
a=0.6
M的转化率为60%。
[答案] C
6.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)
 2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度增大变为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol·L-1时,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度增大变为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是
( )
A.0.16 B.0.08
C.0.04 D.0.02
[解析] 此平衡不受压强影响,两平衡为等效平衡,二者转化率相等。
[答案] C
5.在一容积不变的密闭容器中,充入1 mol的A气体和2
mol的B气体以及1 mol的C气体,发生A+2B
 nC的反应,一段时间后达到平衡状态,此时C的物质的量是反应开始时的2.4倍,且增大压强会使A的转化率增大,升高平衡体系温度,再达平衡后A在平衡体系中的体积分数为13%,则下列判断不正确的是
nC的反应,一段时间后达到平衡状态,此时C的物质的量是反应开始时的2.4倍,且增大压强会使A的转化率增大,升高平衡体系温度,再达平衡后A在平衡体系中的体积分数为13%,则下列判断不正确的是
( )
A.第一次达到平衡时,反应消耗的A为0.7 mol
B.n=2
C.正反应放热
D.正反应吸热
[解析] 由该反应达到平衡后,增大压强会使A的转化率增大,即使平衡向正向移动,可得正反应是一个体积减小的反应,即n<3,而由平衡时C的物质的量是反应开始时的2.4倍,可得平衡是正向反应建立的,而当n=1时,即使所有的A和B全部转化,也只能生成1 mol的C,不可能达到起始的2.4倍,所以n值只能为2;由于第一次达到平衡时生成的C的物质的量为1.4 mol,所以反应消耗的A的物质的量为0.7 mol,同时反应消耗的B为1.4 mol,即此时A的体积分数为0.3/(0.3+0.6+2.4)=9.09%,而在升高温度后A的体积分数变为13%,可知升高温度使平衡逆向移动,所以该反应是正向放热。
[答案] D
4.某温度下,C和H2O(g)在密闭容器中发生下列反应:
①C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)
②CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)
当反应达到平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )
A.0.1 mol/L B.0.9 mol/L
C.1.8 mol/L D.1.9 mol/L
[解析] 设反应①中生成的H2为x,反应②中生成的H2为y,则
C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)
x x x x
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)
y y y y
根据题意,有
解得y=0.9 mol/L。
[答案] B
3.已知一定温度下,2X(g)+Y(g) mZ(g);ΔH=-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1
mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是
mZ(g);ΔH=-a kJ·mol-1(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1
mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是
( )
A.m=4 B.a=b
C.a< D.m≤2
[解析]
2V 加压 甲 V
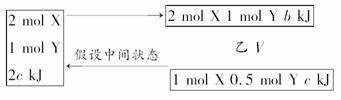
由于b>2c,则表明加压向正方向移动,即正方向为气体体积缩小的反应,则m<3,m为正整数,则D中m≤2正确。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com