
题目列表(包括答案和解析)
11.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示,则:(1)“O”点导电能力为0的理由是__________________________________________________。
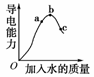
(2)a、b、c三点溶液pH由小到大的顺序是__________________________________。
(3)a、b、c三点中电离程度最大的是________________。
(4)若使c点溶液中c(CH3COO-)增大,溶液pH也增大,可采取的措施有________________________________________________________________________
________________________________________________________________________。(要求类别不同,有几种写几种)
[解析] (1)在“O”点处醋酸未电离(无水存在),无自由移动的离子,所以导电能力为0。
(2)在稀释过程中c(H+)=c(CH3COO-),导电能力越强,说明溶液c(H+)、c(CH3COO-)越大,pH越小,故pH由小到大顺序为:b<a<c。
(3)加水量越多,醋酸浓度越小,电离度越大,故电离度最大的点是c点。
(4)可采取的措施有:① 加入NaOH固体;②加入Na2CO3固体;③加入Zn、Mg等金属;④加入CH3COONa固体等。
[答案] (1)在“O”点处醋酸未电离(无水存在),无自由移动的离子,所以导电能力为0 (2)b<a<c (3)c点
(4)①加入NaOH固体;②加入Na2CO3固体;③加入Zn、Mg等金属;④加入CH3COONa固体等
10.(2007年上海)室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
A.0.1 mol·L-1的盐酸和0.1 mol·L-1的氢氧化钠溶液
B.0.1 mol·L-1的盐酸和0.1 mol·L-1的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=10的氨水
[答案] BD
9.(2007年广东)下列可用于测定溶液pH且精确度最高的是
( )
A.酸碱指示剂 B.pH计
C.精密pH试纸 D.广泛pH试纸
[解析] A项酸碱指示剂只能测定溶液的酸碱性。C项pH试纸只能比较粗略的测出溶液的pH。D项广泛pH试纸只能测出整数的pH。
[答案] B
8.(2007年全国Ⅰ理综)室温时,下列混合溶液的pH一定小于7的是
( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
[解析] pH之和等于14的一强一弱等体混合,结果是弱的过量呈弱的性质。
[答案] C
7.已知25 ℃时有关弱酸的电离平衡常数
|
弱酸 |
氢氟酸 |
硼酸[B(OH)3](一元酸) |
草酸(H2C2O4) |
|
电离平衡常数(25 ℃) |
6.6×10-4 |
5.8×10-10 |
K1=5.9×10-2 K2=6.4×10-5 |
则下列有关说法不正确的是
( )
A.硼酸的电离方程式:H3BO3+H2O
 [H4BO4]-+H+
[H4BO4]-+H+
B.a mol·L-1 HF溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na)>c(F-),则b一定大于a
C.同温下,NaHC2O4中HC2O的电离常数大于K2(草酸的二级电离)
D.NaHC2O4和Na2C2O4混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HC2O)+2c(C2O)
[解析] 由题给信息可知,硼酸为一元酸,硼酸通过配位键结合水电离出的OH-,水释放出H+,A选项正确。B中,HF为一元弱酸,生成的盐水解使溶液呈碱性,当b=a、b>a或a略大于b时,均可能符合题意,所以B不正确。C中,H2C2O4的一级电离产生的H+对二级电离有抑制作用,C说法正确。由电荷守恒可知,D说法正确。
[答案] B
6.(2008年上海)常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是
( )
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液
④氢氧化钠水溶液
A.①④ B.①②
C.②③ D.③④
[解析] 根据题干,该溶液可能是酸溶液也可能是碱溶液。
[答案] A
5.(2008年全国Ⅱ理综)取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
( )
A.0.01 mol/L B.0.017 mol/L
C.0.05 mol/L D.0.50 mol/L
[解析] 本题为一道关于pH的计算题,最后溶液的pH为12,呈碱性,可得c(OH-)=mol·L-1=10-2mol·L-1,设NaOH、HCl溶液浓度均为c mol·L-1,体积分别为3V L、2V L,可得=10-2,得c=0.05 mol·L-1。
[答案] C
4.(2008年北京理综)下列叙述正确的是
( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO)>c(NH)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中增大
[解析] A项,由电荷守恒知c(H+)+c(NH)=2c(SO)+c(OH-),pH=7,c(H+)=c(OH-),故2c(SO)=c(NH),c(SO)<c(NH);B项,醋酸越浓,电离程度越小,当c1=10c2时,前者溶液中H+浓度达不到后者溶液中H+浓度的10倍,pH相差不到1;C项醋酸远远过量;D项加入(NH4)2SO4固体,抑制NH3·H2O的电离,则减小。
[答案] C
3.(2008年全国Ⅰ理综)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的NaA和NaB混合溶液中,下列排序正确的是
( )
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
[解析] 由于酸性强弱为HB>HA,所以A-比B-容易水解,故在浓度均为0.1 mol·L-1的NaA和NaB混合溶液中c(HA)>c(HB),故A项正确。C项中c(B-)、c(A-)应均大于c(OH-)。
[答案] A
2.(2008年天津理综)醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
( )
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
[解析] 电解质溶液是常考考点之一,解答该类题时要注意理解弱电解质的电离、水的电离、盐的水解三种平衡的关系和三种守恒原理。本题A项中微粒间电荷守恒;C项中加入CH3COONa后CH3COO-浓度增大;CH3COOH电离平衡逆向移动;D项中CH3COOH浓度大于NaOH溶液浓度,反应后CH3COOH剩余,且剩余的量多于消耗的量,此时溶液呈酸性。而B项中溶液c(H+)降低的同时c(OH-)增大。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com