
题目列表(包括答案和解析)
3.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙(其pH变色范围为3.1-4.4)作指示剂,下列操作中可能使测定结果偏低的是
( )
A.酸式滴定管在装酸液前未用标准盐酸润洗2-3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2-3次
[解析] 中和滴定误差分析的依据是:
c(NaOH)=,因c(HCl)、V(NaOH)都是代入值,因此c(NaOH)的大小由V(HCl)来决定,当V(HCl)偏大时,c(NaOH)偏高,当V(HCl)偏小时,c(NaOH)偏低,因而只须分析错误操作对V(HCl)的影响可知道c(NaOH)是偏高还是偏低了,本题中A、B、D三个选项都将导致V(HCl)偏大,使测得的c(NaOH)偏高,而C项则使V(HCl)偏小,使测得的c(NaOH)偏低。
[答案] C
2.有①②③三瓶体积相等、浓度都是1 mol·L-1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液的体积是
( )
A.①=③>② B.③>②>①
C.③=②>① D.①=②=③
[解析] “陷阱”设在①中,蒸发时溶液中的水分子和HCl分子将同时挥发出来,溶液中盐酸浓度要降低;对于②中加入CH3COONa固体,CH3COO-+H+ CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。
CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。
[答案] C
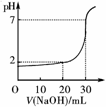
1.如右图所示为10 mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是
( )
|
|
A |
B |
C |
D |
|
|
0.12 |
0.04 |
0.03 |
0.09 |
|
|
0.04 |
0.12 |
0.09 |
0.03 |
[解析] 观察图知,当NaOH用至30 mL时已正好中和,根据c1V1=c2V2,V1∶V2=10∶30=1∶3,则c1∶c2=3∶1,故B、C选项被排除,但又由于加入NaOH 20 mL时,溶液pH已达到2,设HCl浓度为3x,则NaOH浓度为x。c(H+)===0.01 mol·L-1,x=0.03 mol·L-1,3x=0.09 mol·L-1。
[答案] D
14.工业制备氯化铜时,将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?________,理由是________________________________________________________________________
________________________________________________________________________,
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?________,理由是____________________________________。
现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个,填代号)。
A.浓HNO3 B.KMnO4
C.Cl2 D.O2
E.H2O2
(2)除去溶液中Fe2+的方法是调整溶液的pH=9.6,现有下列试剂,均可以使强酸性溶液的pH调整到9.6,可选用的有________。(多选不限)
A.NaOH B.氨水
C.Cu2(OH)2CO3 D.Na2CO3
E.CuO F.Cu(OH)2
[解析] 此题综合性强,考查思维的严密性和前后知识的联系。由题意可知:Fe2+沉淀的pH≥9.6,如果直接调整pH=9.6,Cu2+、Fe3+先于Fe2+沉淀(这两种离子沉淀的pH均比Fe2+沉淀的pH小),故不能直接调整pH=9.6,可将Fe2+氧化成Fe3+。NaClO在酸性条件下与Fe2+的反应是2Fe2++ClO-+2H+===2Fe3++Cl-+H2O,由于反应过程中要消耗H+,溶液pH一定升高。NaClO可以将Fe2+氧化成Fe3+,但引入了新杂质Na+,实际上不能采用。必须应用既能氧化Fe2+又不引入新杂质的氧化剂,例如Cl2、O2、H2O2。同理,调整pH所选用的试剂可以是CuO、Cu2(OH)2CO3、Cu(OH)2等不会引入新杂质的物质。
[答案] (1)不能 因Fe2+沉淀的pH最大,Fe2+沉淀完全时,Cu2+、Fe3+亦沉淀完全 ①A ②不妥当 引入新杂质Na+ CDE (2)CEF
13.工业上制取纯净的CuCl2·2H2O的主要过程是:①将粗氧化铜(含少量Fe)溶解于稀盐酸中。加热、过滤,调节滤液的pH为3;②对①所得滤液按下列步骤进行操作:
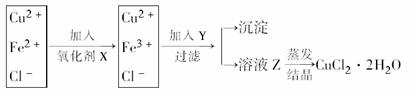
已知Cu2+、Fe2+在pH为4-5时不水解,而Fe3+却几乎完全水解而沉淀。请回答以下问题:
(1)X是什么物质?________。其反应的离子方程式是____________________________。
(2)Y物质应具备的条件是__________________________________________,生产中Y可选______________________。
(3)溶液Z在蒸发结晶时应注意:__________________________________。
[解析] (1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为Cl2;(2)结合题意,调节pH至4-5,使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2;(3)CuCl2溶液在蒸发结晶过程中发生水解,为抑制其水解,根据Cu2++2H2O
 Cu(OH)2+2H+,加入盐酸可起到抑制作用,并且在蒸发过程中要不断搅拌且不能蒸干。
Cu(OH)2+2H+,加入盐酸可起到抑制作用,并且在蒸发过程中要不断搅拌且不能蒸干。
[答案] (1)Cl2 Cl2+2Fe2+===2Fe3++2Cl-
(2)调节溶液酸性,使pH为4-5,且不引进新杂质 CuO或Cu(OH)2 (3)通入HCl气体(或加入盐酸),并不断搅拌且不能蒸干
12.25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(2)溶液中共有________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是________,浓度为0.002 mol·L-1的是________。
(4)________和________两种粒子物质的量之和等于0.01 mol。
(5)________和________两种粒子物质的量之和比氢离子数量多0.008 mol。
[解析] (1)0.01 mol CH3COONa和0.002 mol HCl反应生成0.002 mol的醋酸,还余0.008 mol CH3COONa,所以溶液中存在着CH3COOH的电离平衡、CH3COONa的水解平衡、水的电离平衡三个平衡。(2)溶液中共有粒子CH3COO-、OH-、H+、CH3COOH、H2O、Na+、Cl-7种,浓度为0.01 mol·L-1的是Na+,浓度为0.002 mol·L-1的是Cl-。由物料守恒可知CH3COOH和CH3COO-之和为0.01 mol,由电荷守恒可知,CH3COO-和OH-物质的量之和比氢离子数量多0.008 mol。
[答案] (1)①CH3COO-+H2O
 CH3COOH+OH-
CH3COOH+OH-
②CH3COOH
 CH3COO-+H+ ③H2O
CH3COO-+H+ ③H2O
 H++OH-
H++OH-
(2)7 (3)Na+ Cl- (4)CH3COOH CH3COO-
(5)CH3COO- OH-
11.已知氨水的电离程度与醋酸的电离程度在同温同浓度下相等,25 ℃时0.1 mol·L-1醋酸溶液的pH约为3。某化学兴趣小组探究影响醋酸电离平衡的因素:向0.1 mol·L-1醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。
对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了OH-浓度,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使H+浓度减小,因此溶液的pH增大。
请你设计实验探究哪种解释正确。
(1)你选用下列哪种试剂进行实验________。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
选用该试剂的依据是__________________________________________________。
(2)通过实验可测得溶液pH>3,你的结论是________同学解释正确。
[解析] 本题以实验为载体考查弱电解质电离平衡的影响因素及有关盐类水解的知识。
CH3COOH的电离平衡为:CH3COOH
 CH3COO-+H+,当向CH3COOH的水溶液中加入含有CH3COO-的电解质时,同种离子对电离平衡的影响为主要因素,相反由于CH3COO-的水解较弱,则为次要因素。在CH3COOH的电离平衡体系中,加入CH3COONa晶体,电离出大量CH3COO-,抑制了CH3COOH的电离,使H+浓度减小,因此溶液的pH增大,这为主要影响因素,而CH3COO-的水解影响则为次要因素。要说明这一问题,可选CH3COONH4做试剂进行实验探究,因为CH3COONH4水解显中性,加入固体CH3COONH4后,测得CH3COOH溶液的pH增大,即pH>3,这说明CH3COOH的电离平衡向左移动了,使H+浓度减小了,故乙同学的解释正确
CH3COO-+H+,当向CH3COOH的水溶液中加入含有CH3COO-的电解质时,同种离子对电离平衡的影响为主要因素,相反由于CH3COO-的水解较弱,则为次要因素。在CH3COOH的电离平衡体系中,加入CH3COONa晶体,电离出大量CH3COO-,抑制了CH3COOH的电离,使H+浓度减小,因此溶液的pH增大,这为主要影响因素,而CH3COO-的水解影响则为次要因素。要说明这一问题,可选CH3COONH4做试剂进行实验探究,因为CH3COONH4水解显中性,加入固体CH3COONH4后,测得CH3COOH溶液的pH增大,即pH>3,这说明CH3COOH的电离平衡向左移动了,使H+浓度减小了,故乙同学的解释正确
[答案] (1)B 醋酸铵水解显中性,加入固体醋酸铵后,若测得溶液pH不变,说明甲同学的解释正确;若测得溶液pH增大,则说明乙同学的解释正确 (2)乙
10.25 ℃时,向20 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,其pH变化曲线如下图所示,有关粒子浓度关系的比较中,正确的是
( )
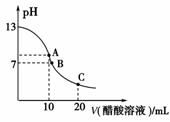
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在A点:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.在B点:c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
D.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
[解析] A点CH3COOH与NaOH正好反应,得到CH3COONa溶液,CH3COO-少量水解,故c(CH3COO-)>c(OH-),A项错。在B点,由电荷守恒知,c(CH3COO-)=c(Na+)。在C点的溶液应为CH3COOH与CH3COONa等浓度的混合液,呈酸性。
[答案] BD
9.实验测得常温下0.1 mol·L-1某一元酸(HA)溶液的pH不等于1,0.1 mol·L-1某一元碱(BOH)溶液里:=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是
( )
A.c(B+)>c(A-)>c(OH-)>c(H+)
B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)+c(H+)=c(A-)+c(OH-)
D.c(B+)>c(A-)>c(H+)>c(OH-)
[解析] 依题意,HA为弱酸,而0.1
mol·L-1BOH中c(OH-)=0.1
mol·L-1,故BOH为强碱,二者恰好反应生成BA,其中A-在水中水解A-+H2O
 HA+OH-,故A正确,由电荷守恒得C正确。
HA+OH-,故A正确,由电荷守恒得C正确。
[答案] AC
8.下列叙述正确的是
( )
A.0.1 mol·L-1氨水中,c(OH-)=c(NH)
B.10 mL 0.02 mol·L-1HCl溶液与10 mL 0.02 mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
[解析] A项,在稀氨水中存在的阴离子只有OH-,存在的阳离子有H+和NH,由电荷守恒得c(OH-)=c(NH)+c(H+)。B项Ba(OH)2是二元强碱,混合后溶液剩余的Ba(OH)2为0.02 mol·L-1×10×10-3L×=0.000 1 mol。C项CH3COONa溶液中的OH-来自CH3COO-的水解和H2O的电离。D项根据物料守恒,在NaHA溶液中,c(Na+)=c(A2-)+c(HA-)+c(H2A)。
[答案] BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com