
题目列表(包括答案和解析)
13.实验室用下列方法测定某水样中O2的含量。

(1)用如上图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2反应的离子方程式为______________________________________________________。
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是________________________________________________________________________。
②用注射器抽取20.00 mL某水样从A处注入锥形瓶中。
③再分别从A处注入含m mol的NaOH溶液及过量的MnSO4溶液。
④完成上述操作后,下面应进行的操作是______________________________________。
c是长橡胶管,使用较长胶管的目的是______________________________________。
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2-3滴____________作指示剂。

⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定的量的关系,即应加适量的H2SO4,使溶液呈__________(填“碱性”“酸性”或“接近中性”),其原因是________________________________________________________________________
________________________________________________________________________。
[答案] (1)2Mn2++O2+4OH-===2MnO(OH)2
①赶走装置内空气,避免空气中O2的干扰
④关闭a、b,将锥形瓶中溶液充分振荡 便于实验过程中锥形瓶的振荡 (3)⑦淀粉溶液 (4)⑨9.0 mg·L-1
⑩接近中性 若碱过量则MnO(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应
12.自来水的质量标准中规定pH为6.5-8.5。某自来水厂的工艺流程示意图如下:
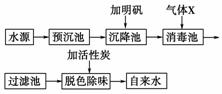
(1)气体X的化学式为____________。
(2)生产中,通入消毒池的气体X一般是定量的,水流在进入消毒池前要进行pH监测调控,这是因为若pH太低,易腐蚀设备;若pH过高,会造成自来水水质下降,不符合卫生标准,这是由于___________________________。
(3)该水厂在技术改造中,采用高效混凝剂--高铁酸钠(Na2FeO4),其反应情况为:
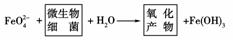
使用Na2FeO4的优点是_________________________________________________。
[答案] (1)Cl2 (2)pH过高会降低氯水的氧化杀菌能力
(3)将净水、消毒工序同时进行,可减少设备投入,用高铁酸钠代替氯水消毒,提高了自来水的质量
11.将饱和氯化铁溶液滴入沸水时,液体变为________色,得到的是__________;反应离子方程式是__________________________________________________,用此分散系进行下列实验:
(1)将其装入U形管中,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色________,这表明__________________,这种现象称为__________________。
(2)向其中加入饱和的硫酸铵溶液发生的现象是____________________,原因是________________________________________________________________________。
(3)向其中逐滴加入过量的稀硫酸,现象是______________________,原因是________________________________________________________________________。
(4)提纯此分散系常常采用的方法叫做____________。
[解析] 本题考查常见胶体的制取、性质、凝聚等知识。只要理解这些知识,就可解答该题。
[答案] 红褐 Fe(OH)3胶体 Fe3++3H2OFe(OH)3(胶体)+3H+
(1)变深 胶粒带正电荷 电泳
(2)凝聚 (NH4)2SO4===2NH+SO,SO中和胶粒所带电荷而使之发生凝聚
(3)先沉淀然后沉淀逐渐溶解 加入少量的硫酸起电解质作用使之凝聚,过量硫酸又同氢氧化铁发生中和而溶解
(4)渗析
10.500 mL 2 mol/L FeCl3溶液和500 mL 2 mol/L明矾溶液分别滴入沸水中,加热制成分散系甲、乙,经测定甲分散系中分散质的粒子大小在1-100 nm之间,乙分散系中分散质的粒子大小在10-9-10-7 m之间。下列关于甲、乙分散系的判断合理的是 ( )
A.在暗室里用一束明亮的“强光”照射甲、乙,发现甲有丁达尔现象,乙没有丁达尔现象
B.向甲、乙中分别滴加过量的氢氧化钠溶液,现象都是“先凝沉,后溶解”
C.向甲、乙中分别滴加过量氢碘酸溶液,现象分别是深褐色溶液、无色溶液
D.蒸干、灼烧FeCl3和明矾溶液会得到对应的固体盐
[答案] C
9.实验中因装配仪器,不慎划破手指出血,可立即在出血点处滴FeCl3溶液应急止血,其原因是
( )
A.FeCl3具有强氧化性,使血液中的蛋白质被氧化凝固止血
B.FeCl3与血液发生化学反应,生成沉淀物质而止血
C.FeCl3水解生成Fe(OH)3沉淀而沉积于划破处止血
D.FeCl3是电解质,使血液中的蛋白质很快凝结而止血
[解析] 血液实际上是一种胶体,要使胶体凝聚,可采用加热、加电解质溶液和加带相反电荷的胶体等方法。电解质溶液中的Fe3+具有较高的电荷数,可让血液凝结而止血。
[答案] D
8.下列现象或新技术应用中,不涉及胶体性质的是
( )
A.在饱和氯化铁溶液中逐滴加NaOH溶液,产生红褐色沉淀
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
[答案] A
7.下列关于胶体的叙述不正确的是
( )
A.布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
B.光线透过胶体使胶体发生丁达尔效应
C.用渗析的方法净化胶体是,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
[解析] 布朗运动并不是胶体微粒特有的运动方式,溶液中的溶质分子或离子在溶液分子作用下,也在不断地做着无规则运动。因此,无法利用布朗运动区别胶体和溶液。
[答案] A
6.用高铁酸钠(Na2FeO4)对来自河、湖的淡水消毒,是城市饮水处理新技术,下列对铁酸钠用于饮水处理的分析正确的是
( )
①Na2FeO4在溶液中显酸性,能杀菌消毒
②在Na2FeO4中铁元素显+6价,具有强氧化性,能杀菌消毒
③Na2FeO4的还原产物为Fe3+,其易水解产生Fe(OH)3胶体,使水中悬浮物聚沉
④Na2FeO4的还原产物Fe2+水解得Fe(OH)2胶体,使水中悬浮物聚沉
A.①② B.②③
C.①③ D.②④
[解析] 高铁酸钠中铁元素的化合价显+6价,具有很强的氧化性,是强氧化剂,因此能杀菌消毒。同时,高铁酸钠作氧化剂时,其还原产物为Fe3+,Fe3+水解得到Fe(OH)3胶体,胶粒具有很强的吸附能力,因此又能净水。答案为B。
[答案] B
5.常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
( )
A.pH=12 的Ba(OH)2 B.pH=12 的氨水
C.0.005 mol/L NaOH D.0.05 mol/L BaCl2
[解析] 甲基橙的变色范围:当溶液的pH值小于3.1时为红色、pH大于4.4时为黄色,c(H+)为0.01 mol·L-1的H2SO4与c(OH-)为0.01 mol·L-1的Ba(OH)2或c(OH-)为0.01 mol·L-1的NH3·H2O溶液等体积混合时pH值均不小于7,溶液显黄色。与0.005 mol·L-1 NaOH溶液或0.05 mol·L-1的BaCl2溶液等体积混合时pH值均小于3.1,溶液显红色。
[答案] CD
4.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A.V3>V2>V1 B.V3=V2=V1
C.V3>V2=V1 D.V1=V2>V3
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com