
题目列表(包括答案和解析)
7.向含有1 mol KAl(SO4)2的溶液中逐滴加入氢氧化钡溶液,充分反应。下列说法不正确的是
( )
A.当Al3+恰好完全沉淀时,消耗氢氧化钡1.5 mol
B.当SO恰好完全沉淀时,Al3+全部转化为AlO
C.当向溶液中加入1.5 mol氢氧化钡时,反应可用下列离子方程式表示:2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
D.随加入的氢氧化钡的物质的量不断增大,沉淀的物质的量不断增大
[解析] 含有1 mol KAl(SO4)2的溶液中含Al3+ 1 mol、SO 2 mol,逐滴加入氢氧化钡溶液,开始有Al(OH)3和BaSO4沉淀,当加入1.5 mol氢氧化钡时,Al3+沉淀完全,SO有剩余,继续滴加氢氧化钡溶液,Al(OH)3转化为AlO,剩余的SO继续沉淀,至SO沉淀完全,Al3+全部转化为AlO。答案为D。
[答案] D
6.将物质的量相等的硫酸铝和硫酸铵溶于水形成V mL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
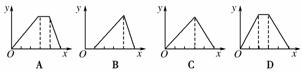
[解析] 硫酸铝中加入氢氧化钠先产生沉淀,后沉淀溶解,其中氢氧化铝沉淀与将氢氧化铝沉淀溶解所需的氢氧化钠的物质的量的比为3∶1,而硫酸铵与氢氧化钠反应不产生沉淀,只产生氨气,故在产生氢氧化铝沉淀后,有一段图象表现为沉淀量不变,即氢氧化钠与硫酸铵反应产生氨气段,故A正确。
[答案] A
5.铍(Be)与铝的性质相似,已知反应BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能进行完全。据此作出的以下推断中正确的是
( )
A.常温时,BeCl2溶液pH >7,将其蒸干、灼烧后可得残留物BeCl2
B.常温时,Na2BeO2溶液pH<7,将其蒸干、灼烧后可得残留物Na2BeO2
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性较强,说明BeCl2一定是离子化合物
[解析] BaCl2溶液由于Be2+水解溶液显酸性,将其蒸干、灼烧后得到BeO,A错;Na2BeO2溶液由于BeO水解溶液显碱性,将其蒸干、灼烧后得到Na2BeO2,B错;根据化合物在熔融状态下能否导电来判断其是否是离子化合物,BeCl2水溶液的导电性较强,不能说明BeCl2一定是离子化合物,D错。
[答案] C
4.下列有关金属元素特征的叙述正确的是
( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均相同
D.金属元素的单质在常温下均为金属晶体
[解析] A不正确,对于变价金属离子,较低价态的金属离子既有氧化性又有还原性,例Fe2+,Fe2++Zn===Fe+Zn2+,2Fe2++Cl2===2Fe3++2Cl-;B正确,因为金属元素的原子只具有还原性,故在化合物中只显正价;C不正确,有变价金属元素;D不正确,少数金属在常温下为非晶体,如Hg。
[答案] B
3.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是
( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
[答案] B
2.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2 mol·L-1H2SO4溶液 B.18 mol·L-1H2SO4溶液
C.6 mol·L-1KOH溶液 D.3 mol·L-1HNO3溶液
[答案] A
1.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图所示),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
( )
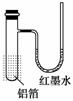
A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
[解析] 本题中涉及的反应有:2Al+3Hg(NO3)2===2Al(NO3)3+3Hg,4Al+3O2===2Al2O3,两个反应均为氧化还原反应;由题中所述现象“红墨水柱右端上升”,可推知试管中气体体积受热膨胀,意味着铝与氧气反应是放热反应。铝片上生成的“白毛”是氧化铝。
[答案] D
0.1 mol·L-1×Va L-10-2mol·L-1×Vb L
=10-3mol·L-1×(Va+Vb)L,解得Va∶Vb=1∶9。
[答案] 10-13 大于 水的电离是吸热的,升温时水的电离平衡正向移动,KW增大,因该温度下的KW大于25 ℃时水的KW=1×10-14,所以该温度大于25 ℃
(1)1∶10 (2)10∶1 (3)1∶9
21.(12分)某温度(t ℃)时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的KW=____________。则该温度(选填大于、小于或等于)__________25 ℃,其理由是________________________________________________________________________
________________________________________________________________________。
在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合液为中性,且a=12,b=2,则Va∶Vb=________;
(2)若所得混合液为中性,且a+b=12,则Va∶Vb=________;
(3)若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=_______。
[解析] 在t ℃,pH=11的溶液中c(H+)=10-11×10-2=10-13;
(1)pH=a则c(H+)=10-a mol·L-1
由KW=c(H+)·c(OH-)=10-13 mol2·L-2得c(OH-)=10a-13 mol·L-1,pH=b
则c(H+)=10-bmol·L-1,若混合后溶液呈中性,则
Va L×10a-13mol·L-1=Vb L×10-bmol·L-1,==1013-(a+b)。因为a=12,b=2,代入可知=10-1=1∶10。
(2)将a+b=12代入=1013-(a+b)可得:=10=10∶1。
(3)当a=12时,c(OH-)=0.1 mol·L-1,b=2时,
c(H+)=10-2mol·L-1。若混合溶液的pH=10,
则c(OH-)=10-3mol·L-1,OH-有剩余:
20.(12分)高一某班学生对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能发生反应,设计并完成了如下图所示实验。

X溶液是________,滴入的量一般为________。
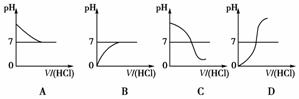
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有氢氧化钠溶液的试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直到盐酸过量。
①写出测定溶液pH的方法:___________________________________。
②图中哪个图象符合该同学的记录:________(填序号)。
(3)你认为甲、乙两位同学的实验中,________(填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:________________________________________________________________________
________________________________________________________________________。
Ⅱ.丙同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置。实验时先在烧杯中加入20 g 40%的氢氧化钠溶液,再逐滴加入该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系图(如下图所示)

(4)请以此次测定的结果,计算该盐酸的实际质量分数。
(5)请分析你的计算结果与标签标示的质量分数不一致的可能原因________________________________________________________________________。
[答案] Ⅰ.(1)酚酞 1-2滴
(2)①用洁净的玻璃棒蘸取待测液滴到pH试纸上,半分钟后,将试纸的颜色与标准比色卡对照,读出溶液的pH即可 ②C
(3)乙同学 甲同学的实验不能充分说明盐酸与氢氧化钠发生了反应,有可能是盐酸和红色物质反应生成了无色物质。乙同学的实验,随着盐酸的滴加,溶液的pH由大于7逐渐减小,这充分证明溶液中的氢氧化钠因反应而消耗了
Ⅱ.(4)29.2% (5)盐酸具有挥发性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com